Химия щелочных металлов и их соединений
Щелочные металлы
1. Положение в периодической системе химических элементов
2. Электронное строение и закономерности изменения свойств
3. Физические свойства
4. Нахождение в природе
5. Способы получения
6. Качественные реакции
7. Химические свойства
7.1. Взаимодействие с простыми веществами
7.1.1. Взаимодействие с галогенами
7.1.2. Взаимодействие с серой и фосфором
7.1.3. Взаимодействие с водородом
7.1.4. Взаимодействие с азотом
7.1.5. Взаимодействие с углеродом
7.1.6. Горение
7.2. Взаимодействие со сложными веществами
7.2.1. Взаимодействие с водой
7.2.2. Взаимодействие с минеральными кислотами
7.2.3. Взаимодействие с серной кислотой
7.2.4. Взаимодействие с азотной кислотой
7.2.5. Взаимодействие со слабыми кислотами
7.2.6. Взаимодействие с солями
Оксиды щелочных металлов
1. Способы получения
2. Химические свойства
2.2. Взаимодействие с кислотами
2.3. Взаимодействие с водой
2.4. Взаимодействие с кислотами
Пероксиды щелочных металлов
1. Химические свойства
1.1. Взаимодействие с водой
1.2. Взаимодействие с кислотными и амфотерными оксидами
1.3. Взаимодействие с кислотами
1.4. Разложение
1.5. Взаимодействие с восстановителями
1.6. Взаимодействие с окислителями
Гидроксиды щелочных металлов (щелочи)
1. Способы получения
2. Химические свойства
2.1. Взаимодействие щелочей с кислотами
2.2. Взаимодействие щелочей с кислотными оксидами
2.3. Взаимодействие щелочей с амфотерными оксидами и гидроксидами
2.4. Взаимодействие щелочей с кислыми солями
2.5. Взаимодействие щелочей с неметаллами
2.6. Взаимодействие щелочей с металлами
2.7. Взаимодействие щелочей с солями
2.8. Разложение щелочей
2.9. Диссоциация щелочей
Соли щелочных металлов
Щелочные металлы
Положение в периодической системе химических элементов
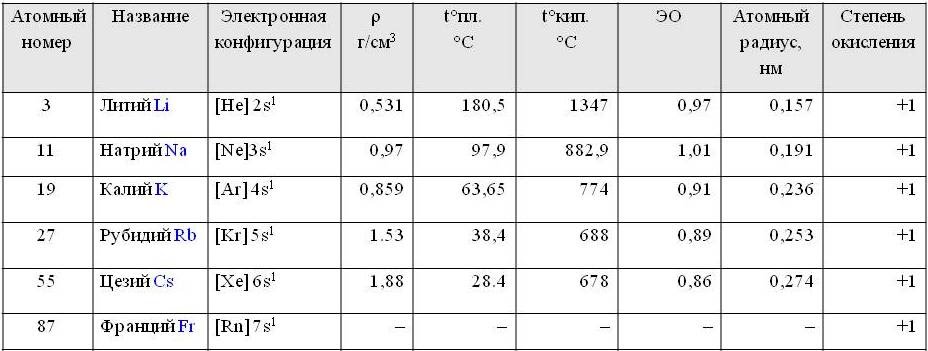
Щелочные металлы расположены в главной подгруппе первой группы периодической системы химических элементов Д.И. Менделеева (или просто в 1 группе в длиннопериодной форме ПСХЭ). Это литий Li, натрий Na, калий K, цезий Cs, рубидий Rb и франций Fr.
Электронное строение щелочных металлов и основные свойства
Электронная конфигурация внешнего энергетического уровня щелочных металлов: ns1, на внешнем энергетическом уровне находится 1 s-электрон. Следовательно, типичная степень окисления щелочных металлов в соединениях +1.
Рассмотрим некоторые закономерности изменения свойств щелочных металлов.
В ряду Li-Na-K-Rb-Cs-Fr, в соответствии с Периодическим законом, увеличивается атомный радиус
Физические свойства
Все щелочные металлы — вещества мягкие, серебристого цвета. Свежесрезанная поверхность их обладает характерным блеском.
Кристаллическая решетка щелочных металлов в твёрдом состоянии — металлическая. Следовательно, щелочные металлы обладают высокой тепло- и электропроводимостью. Кипят и плавятся при низких температурах. Они имеют также небольшую плотность.
Нахождение в природе
Как правило, щелочные металлы в природе присутствуют в виде минеральных солей: хлоридов, бромидов, йодидов, карбонатов, нитратов и др. Основные минералы, в которых присутствуют щелочные металлы:
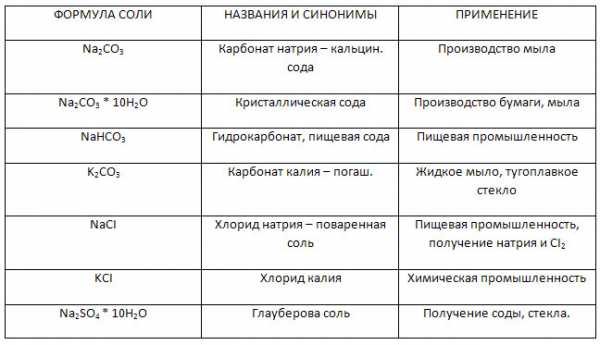
Поваренная соль, каменная соль, галит — NaCl — хлорид натрия
Сильвин KCl — хлорид калия
Сильвинит NaCl · KCl
Глауберова соль Na2SO4⋅10Н2О – декагидрат сульфата натрия
Едкое кали KOH — гидроксид калия
Поташ K2CO3 – карбонат калия
Поллуцит — алюмосиликат сложного состава с высоким содержанием цезия:
Способы получения
Литий получают в промышленности электролизом расплава хлорида лития в смеси с KCl или BaCl2 (эти соли служат для понижения темпе-ратуры плавления смеси):
2LiCl = 2Li + Cl2
Натрий получают электролизом расплава хлорида натрия с добавками хлорида кальция:
2NaCl (расплав) → 2Na + Cl2
Электролитом обычно служит смесь NaCl с NaF и КСl (что позволяет проводить процесс при 610–650°С).
Калий получают также электролизом расплавов солей или расплава гидроксида калия. Также распространены методы термохимического восстановления: восстановление калия из расплавов хлоридов или гидроксидов. В качестве восстановителей используют пары натрия, карбид кальция, алюминий, кремний:
KCl + Na = K↑ + NaCl
KOH + Na = K↑ + NaOH
Цезий можно получить нагреванием смеси хлорида цезия и специально подготовленного кальция:
Са + 2CsCl → 2Cs + CaCl2
В промышленности используют преимущественно физико-химические методы выделения чистого цезия: многократную ректификацию в вакууме.
Качественные реакции
Качественная реакция на щелочные металлы — окрашивание пламени солями щелочных металлов.

Li — карминно-красный
Na — жѐлтый
K — фиолетовый
Rb — буро-красный
Cs — фиолетово-красный
Химические свойства
1. Щелочные металлы — сильные восстановители. Поэтому они реагируют почти со всеми неметаллами.
1.1. Щелочные металлы легко реагируют с галогенами с образованием галогенидов:
2K + I2 = 2KI
1.2. Щелочные металлы реагируют с серой с образованием сульфидов:
2Na + S = Na2S
1.3. Щелочные металлы активно реагируют с фосфором и водородом (очень активно). При этом образуются бинарные соединения —
3K + P = K3P
2Na + H2 = 2NaH
1.4. С азотом литий реагирует при комнатной температуре с образованием нитрида:
6Li + N2 = 2Li3N
Остальные щелочные металлы реагируют с азотом при нагревании.
1.5. Щелочные металлы реагируют с углеродом с образованием карбидов, преимущественно ацетиленидов:
2Na + 2C = Na2C2
1.6. При взаимодействии с кислородом каждый щелочной металл проявляет свою индивидуальность: при горении на воздухе литий образует оксид, натрий – преимущественно пероксид
, калий и остальные металлы – надпероксид.4Li + O2 = 2Li2O
2Na + O2 = Na2O2
K + O2 = KO2
Цезий самовозгорается на воздухе, поэтому его хранят в запаянных ампулах. Видеоопыт самовозгорания цезия на воздухе можно посмотреть здесь.
2. Щелочные металлы активно взаимодействуют со сложными веществами:
2.1. Щелочные металлы бурно (со взрывом) реагируют с водой. Взаимодействие щелочных металлов с водой приводит к образованию щелочи и водорода. Литий реагирует бурно, но без взрыва.
Например, калий реагирует с водой очень бурно:
2K0 + H
Видеоопыт: взаимодействие щелочных металлов с водой можно посмотреть здесь.
2.2. Щелочные металлы взаимодействуют с минеральными кислотами (с соляной, фосфорной и разбавленной серной кислотой) со взрывом. При этом образуются соль и водород.
Например, натрий бурно реагирует с соляной кислотой:
2Na + 2HCl = 2NaCl + H2↑
2.3. При взаимодействии щелочных металлов с концентрированной серной кислотой выделяется сероводород.
Например, при взаимодействии натрия с концентрированной серной кислотой образуется сульфат натрия, сероводород и вода:
8Na + 5H2SO4( конц.) → 4Na2SO4 + H2S + 4H2O
2.4. Щелочные металлы реагируют с азотной кислотой. При взаимодейст-вии с концентрированной азотной кислотой образуется оксид азота (I):
8Na + 10HNO3 (конц) → N2O + 8NaNO3 + 5H2O
С разбавленной азотной кислотой образуется молекулярный азот:
10Na + 12HNO3 (разб)→ N2 +10NaNO3 + 6H2O
При взаимодействии щелочных металлов с очень разбавленной азотной кислотой образуется нитрат аммония:
8Na + 10HNO3 = 8NaNO3 + NH4NO3 + 3H2O
2.5. Щелочные металлы могут реагировать даже с веществами, которые проявляют
Например, при взаимодействии лития с аммиаком образуются амиды и водород:
2Li + 2NH3 = 2LiNH2 + H2 ↑
Ацетилен с натрием образует ацетиленид натрия и также водород:
Н ─ C ≡ С ─ Н + 2Na → Na ─ C≡C ─ Na + H2
Фенол с натрием реагирет с образованием фенолята натрия и водорода:
2C6H5OH + 2Na → 2C6H5ONa + H2↑
Метанол с натрием образуют метилат натрия и водород:
2СН3ОН + 2Na → 2 CH3ONa + H2↑
Уксусная кислота с литием образует ацетат лития и водород:
2СH3COOH + 2Li → 2CH3COOOLi + H2↑
Щелочные металлы реагируют с галогеналканами (реакция Вюрца).
Например, хлорметан с натрием образует этан и хлорид натрия:
2CH3Cl + 2Na → C2H6 + 2NaCl
2.6. В расплаве щелочные металлы могут вытеснять менее активные металлы из солей. Обратите внимание! В растворе щелочные металлы будут взаимодействовать с водой, а не с солями других металлов.
Например, натрий вытесняет алюминий из расплава хлорида алюминия :
3Na + AlCl3 → 3NaCl + Al
Оксиды щелочных металлов
Способы получения
Оксиды щелочных металлов (кроме лития) можно получить только косвенными методами: взаимодействием натрия с окислителями в расплаве:
1. Оксид натрия можно получить взаимодействием натрия с нитратом натрия в расплаве:
10Na + 2NaNO3 → 6Na2O + N2 ↑
2. Взаимодействием натрия с пероксидом натрия:
2Na + Na2O2 → 2Na2O
3. Взаимодействием натрия с расплавом щелочи:
2Na + 2NaOН → 2Na2O + Н2↑
4. Оксид лития можно получить разложением гидроксида лития:
2LiOН → Li2O + Н2O
Химические свойства
Оксиды щелочных металлов — типичные основные оксиды. Вступают в реакции с кислотными и амфотерными оксидами, кислотами, водой.
1. Оксиды щелочных металлов взаимодействуют с кислотными и амфотерными оксидами:
Например, оксид натрия взаимодействует с оксидом фосфора (V):
3Na2O + P2O5 → 2Na3PO4
Оксид лития взаимодейсвует с амфотерным оксидом алюминия:
Na2O + Al2O3 → 2NaAlO2
2. Оксиды щелочных металлов взаимодействуют с кислотами с образованием средних и кислых солей (с многоосновными кислотами).
Например, оксид калия взаимодействует с соляной кислотой с образованием хлорида калия и воды:
K2O + 2HCl → 2KCl + H2O
3. Оксиды щелочных металлов активно взаимодействуют с водой с образованием щелочей.
Например, оксид лития взаимодействует с водой с образованием гидроксида лития:
Li2O + H2O → 2LiOH
4. Оксиды щелочных металлов окисляются кислородом (кроме оксида лития): оксид натрия — до пероксида, оксиды калия, рубидия и цезия – до надпероксида.
2Na2O + O2 = 2Na2O2
Пероксиды щелочных металлов
Химические свойства
Свойства пероксидов очень похожи на свойства оксидов. Однако пероксиды щелочных металлов, в отличие от оксидов, содержат атомы кислорода со степенью окисления -1. Поэтому они могут могут проявлять как окислительные, так и восстановительные свойства.
1. Пероксиды щелочных металлов взаимодействуют с водой. При этом на холоде протекает обменная реакция, образуются щелочь и пероксид водорода:
Na2O2 + 2H2O (хол.) = 2NaOH + H2O2
При нагревании пероксиды диспропорционируют в воде, образуются щелочь и кислород:
2Na2O2 + 2H2O (гор.) = 4NaOH + O2↑
2. Пероксиды диспропорционируют при взаимодействии с кислотными оксидами.
Например, пероксид натрия реагирует с углекислым газом с образовани-ем карбоната натрия и кислорода:
2Na2O2 + CO2 = 2Na2CO3 + O2↑
3. При взаимодействии с минеральными кислотами на холоде пероксиды вступают в обменную реакцию. При этом образуются соль и перекись водорода:
Na2O2 + 2HCl = 2NaCl + H2O2
При нагревании пероксиды, опять-таки, диспропорционируют:
2Na2O2 + 2H2SO4 (разб.гор.) = 2Na2SO4 + 2H2O + O2↑
4. Пероксиды щелочных металлов разлагаются при нагревании, с образованием оксида и кислорода:
2Na2O2 = 2Na2O + O2↑
5. При взаимодействии с восстановителями пероксиды проявляют окис-лительные свойства.
Например, пероксид натрия с угарным газом реагирует с образованием карбоната натрия:
Na2O2 + CO = Na2CO3
Пероксид натрия с сернистым газом также вступает в ОВР с образовани-ем сульфата натрия:
Na2O2 + SO2 = Na2SO4
2Na2O2 + S = Na2SO3 + Na2O
Na2O2 + 2H2SO4 + 2NaI = I2 + 2Na2SO4 + 2H2O
Na2O2 + 2H2SO4 + 2FeSO4 = Fe2(SO4)3 + Na2SO4 + 2H2O
3Na2O2 + 2Na3[Cr(OH)6] = 2Na2CrO4 + 8NaOH + 2H2O
6. При взаимодействии с сильными окислителями пероксиды проявляют свойства восстановителей и окисляются, как правило, до молекулярного кислорода.
Например, при взаимодействии с подкисленным раствором пермангана-та калия пероксид натрия образует соль и молекулярный кислород:
5Na2O2 + 8H2SO4 + 2KMnO4 = 5O2 + 2MnSO4 + 8H2O + 5Na2SO4 + K2SO4
Гидроксиды щелочных металлов (щелочи)
Способы получения
1. Щелочи получают электролизом растворов хлоридов щелочных метал-лов:
2NaCl + 2H2O → 2NaOH + H2 + Cl2
2. При взаимодействии щелочных металлов, их оксидов, пероксидов, гид-ридов и некоторых других бинарных соединений с водой также образуют-ся щелочи.
Например, натрий, оксид натрия, гидрид натрия и пероксид натрия при растворении в воде образуют щелочи:
2Na + 2H2O → 2NaOH + H2
Na2O + H2O → 2NaOH
2NaH + 2H2O → 2NaOH + H2
Na2O2 + H2O → 2NaOH + H2O2
3. Некоторые соли щелочных металлов (карбонаты, сульфаты и др.) при взаимодействии с гидроксидами кальция и бария также образуют щелочи.
Например, карбонат калия с гидроксидом кальция образует карбонат кальция и гидроксид калия:
K2CO3 + Ca(OH)2 → CaCO3↓ + 2KOH
Химические свойства
1. Гидроксиды щелочных металлов реагируют со всеми кислотами (и сильными, и слабыми, и растворимыми, и нерастворимыми). При этом образуются средние или кислые соли, в зависимости от соотношения реагентов.
Например, гидроксид калия с фосфорной кислотой реагирует с образова-нием фосфатов, гидрофосфатов или дигидрофосфатов:
3KOH + H3PO4 → K3PO4 + H2O
2KOH + H3PO4 → K2HPO4 + 2H2O
KOH + H3PO4 → KH2PO4 + H2O
2. Гидроксиды щелочных металлов реагируют с кислотными оксидами. При этом образуются средние или кислые соли, в зависимости от соотношения реагентов.
Например, гидроксид натрия с углекислым газом реагирует с образова-нием карбонатов или гидрокарбонатов:
2NaOH(избыток) + CO2 → Na2CO3 + H2O
NaOH + CO2(избыток) → NaHCO3
Необычно ведет себя оксид азота (IV) при взаимодействии с щелочами. Дело в том, что этому оксиду соответствуют две кислоты — азотная (HNO3) и азотистая (HNO2). «Своей» одной кислоты у него нет. Поэтому при взаимодействии оксида азота (IV) с щелочами образуются две соли- нитрит и нитрат:
2NO2 + 2NaOH = NaNO3 + NaNO2 + H2O
А вот в присутствии окислителя, например, молекулярного кислорода, образуется только одна соль — нитрат, т.к. азот +4 только повышает степень окисления:
2KOH + 2NO2 + O2 = 2KNO3 + H2O
3. Гидроксиды щелочных металлов реагируют с амфотерными оксидами и гидроксидами. При этом в расплаве образуются средние соли, а в растворе комплексные соли.
Например, гидроксид натрия с оксидом алюминия реагирует в расплаве с образованием алюминатов:
2NaOH + Al2O3 → 2NaAlO2 + H2O
в растворе образуется комплексная соль — тетрагидроксоалюминат:
2NaOH + Al2O3 + 3H2O → 2Na[Al(OH)4]
Еще пример: гидроксид натрия с гидроксидом алюминия в расплаве образут также комплексную соль:
NaOH + Al(OH)3 → Na[Al(OH)4]
4. Щелочи также взаимодействуют с кислыми солями. При этом образуются средние соли, или менее кислые соли.
Например: гидроксид калия реагирует с гидрокарбонатом калия с образованием карбоната калия:
KOH + KHCO3 → K2CO3 + H2O
5. Щелочи взаимодействуют с простыми веществами-неметаллами (кроме инертных газов, азота, кислорода, водорода и углерода).
При этом кремний окисляется щелочами до силиката и водорода:
2NaOH + Si + H2O → Na2SiO3 + H2
Фтор окисляет щелочи. При этом выделяется молекулярный кислород:
4NaOH + 2F2 → 4NaF + O2 (OF2)+ 2H2O
Другие галогены, сера и фосфор — диспропорционируют в щелочах:
3KOH + P4 + 3H2O = 3KH2PO2 + PH3↑
2KOH(холодный) + Cl2 = KClO + KCl + H2O
6KOH(горячий) + 3Cl2 = KClO3 + 5KCl + 3H2O
Сера взаимодействует с щелочами только при нагревании:
6NaOH + 3S = 2Na2S + Na2SO3 + 3H2O
6. Щелочи взаимодействуют с амфотерными металлами, кроме железа и хрома. При этом в расплаве образуются соль и водород:
2KOH + Zn → K2ZnO2 + H2
В растворе образуются комплексная соль и водород:
2NaOH + 2Al + 6Н2О = 2Na[Al(OH)4] + 3Н2
7. Гидроксиды щелочных металлов вступают в обменные реакции с растворимыми солями.
С щелочами взаимодействуют соли тяжелых металлов.
Например, хлорид меди (II) реагирует с гидроксидом натрия с образованием хлорида натрия и осадка гидроксида меди (II):
2NaOH + CuCl2 = Cu(OH)2↓+ 2NaCl
Также с щелочами взаимодействуют соли аммония.
Например, при взаимодействии хлорида аммония и гидроксида натрия образуются хлорид натрия, аммиак и вода:
NH4Cl + NaOH = NH3 + H2O + NaCl
8. Гидроксиды всех щелочных металлов плавятся без разложения, гидроксид лития разлагается при нагревании до температуры 600°С:
2LiOH → Li2O + H2O
9. Все гидроксиды щелочных металлов проявляют свойства сильных оснований. В воде практически нацело диссоциируют, образуя щелочную среду и меняя окраску индикаторов.
NaOH ↔ Na+ + OH—
10. Гидроксиды щелочных металлов в расплаве подвергаются электролизу. При этом на катоде восстанавливаются сами металлы, а на аноде выделяется молекулярный кислород:
4NaOH → 4Na + O2 + 2H2O
Соли щелочных металлов
Нитраты и нитриты щелочных металлов
Нитраты щелочных металлов при нагревании разлагаются на нитраты и кислород. Исключение — нитрат лития. Он разлагается на оксид лития, оксид азота (IV) и кислород.
Например, нитрат натрия разлагается при нагревании на нитрит натрия и молекулярный кислород:
2NaNO3 → 2NaNO2 + O2
Нитраты щелочных металлов в реакциях могут выступать в качестве окислителей.
Нитриты щелочных металлов могут быть окислителями или восстановителями.
В щелочной среде нитраты и нитриты — очень мощные окислители.
Например, нитрат натрия с цинком в щелочной среде восстанавливается до аммиака:
NaNO3 + 4Zn + 7NaOH + 6H2O = 4Na2[Zn(OH)4] + NH3↑
Сильные окислители окисляют нитриты до нитратов.
Например, перманганат калия в кислой среде окисляет нитрит натрия до нитрата натрия:
5NaNO2 + 2KMnO4 + 3H2SO4 = 5NaNO3 + 2MnSO4 + K2SO4 + 3H2O
Поделиться ссылкой:
chemege.ru
Щелочные металлы и их соединения
Щелочные металлы и их соединения.
Щелочные металлы.
Щелочные металлы легко реагируют с неметаллами:
2K + I2 = 2KI
2Na + H2 = 2NaH
6Li + N2 = 2Li3N (реакция идет уже при комнатной температуре)
3K + P = K3P
2Na + S = Na2S
2Na + 2C = Na2C2
В реакциях с кислородом каждый щелочной металл проявляет свою индивидуальность: при горении на воздухе литий образует оксид, натрий – пероксид, калий – надпероксид.
4Li + O2 = 2Li2O
2Na + O2 = Na2O2
K + O2 = KO2
Получение оксида натрия:
10Na + 2NaNO3 = 6Na2O + N2 ↑
2Na + Na2O2 = 2Na2O
2Na + 2NaOН = 2Na2O + Н2↑
Взаимодействие с водой приводит к образованию щелочи и водорода.
2Na + 2H2O = 2NaOH + H2↑
Взаимодействие с кислотами:
2Na + 2HCl = 2NaCl + H2↑
8Na + 5H2SO4(конц.) = 4Na2SO4 + H2S + 4H2O
2Li + 3H2SO4(конц.) = 2LiHSO4 + SO2 + 2H2O
8Na + 10HNO3 = 8NaNO3 + NH4NO3 + 3H2O
При взаимодействии с аммиаком образуются амиды и водород:
2Li + 2NH3 = 2LiNH2 + H2 ↑
Взаимодействие с органическими соединениями:
Н ─ C ≡ С─ Н + 2Na → Na ─ C≡C ─ Na + H2
2CH3Cl + 2Na → C2H6 + 2NaCl
2C6H5OH + 2Na → 2C6H5ONa + H2↑
2СН3ОН + 2Na → 2 CH3ONa + H2↑
2СH3COOH + 2Na → 2CH3COOONa + H2↑
Качественной реакцией на щелочные металлы является окрашивание пламени их катионами. Ион Li+ окрашивает пламя в кармино-красный цвет, ион Na+ – в желтый, К+ – в фиолетовый
Соединения щелочных металлов
Оксиды.
Оксиды щелочных металлов типичные основные оксиды. Вступают в реакции с кислотными и амфотерными оксидами, кислотами, водой.
3Na2O + P2O5 = 2Na3PO4
Na2O + Al2O3 = 2NaAlO2
Na2O + 2HCl = 2NaCl + H2O
Na2O + 2H+ = 2Na+ + H2O
Na2O + H2O = 2NaOH
Пероксиды.
2Na2O2 + CO2 = 2Na2CO3 + O2↑
Na2O2 + CO = Na2CO3
Na2O2 + SO2 = Na2SO4
2Na2O + O2 = 2Na2O2
Na2O + NO + NO2 = 2NaNO2
2Na2O2 = 2Na2O + O2↑
Na2O2 + 2H2O (хол.) = 2NaOH + H2O2
2Na2O2 + 2H2O (гор.) = 4NaOH + O2↑
Na2O2 + 2HCl = 2NaCl + H2O2
2Na2O2 + 2H2SO4 (разб.гор.) = 2Na2SO4 + 2H2O + O2↑
2Na2O2 + S = Na2SO3 + Na2O
5Na2O2 + 8H2SO4 + 2KMnO4 = 5O2 + 2MnSO4 + 8H2O + 5Na2SO4 + K2SO4
Na2O2 + 2H2SO4 + 2NaI = I2 + 2Na2SO4 + 2H2O
Na2O2 + 2H2SO4 + 2FeSO4 = Fe2(SO4)3 + Na2SO4 + 2H2O
3Na2O2 + 2Na3[Cr(OH)6] = 2Na2CrO4 + 8NaOH + 2H2O
Основания (щелочи).
2NaOH(избыток) + CO2 = Na2CO3 + H2O
NaOH + CO2(избыток) = NaHCO3
SO2 + 2NaOH (избыток) = Na2SO3 + H2O
SiO2 + 2NaOH Na2SiO3 + H2O
2NaOH + Al2O3 2NaAlO2 + H2O
2NaOH + Al2O3 + 3H2O = 2Na[Al(OH)4]
NaOH + Al(OH)3 = Na[Al(OH)4]
2NaOH + 2Al + 6Н2О = 2Na[Al(OH)4] + 3Н2
2NO2 + 2NaOH = NaNO3 + NaNO2 + H2O
P2O5 + 4NaOH = 2Na2HPO4 + H2O
2KOH + 2NO2 + O2 = 2KNO3 + H2O
KOH + KHCO3 = K2CO3 + H2O
2NaOH + Si + H2O = Na2SiO3 + H2
3KOH + P4 + 3H2O = 3KH2PO2 + PH3↑
2KOH(холодный) + Cl2 = KClO + KCl + H2O
6KOH(горячий) + 3Cl2 = KClO3 + 5KCl + 3H2O
6NaOH + 3S = 2Na2S + Na2SO3 + 3H2O
Соли.
2NaNO3 2NaNO2 + O2
Na2CO3 + 2NH4Cl = 2NaCl + CO2 + 2NH3 + Н2О
NaHCO3 + HNO3 = NaNO3 + CO2 + H2O
5NaNO2 + 2KMnO4 + 3H2SO4 = 5NaNO3 + 2MnSO4 + K2SO4 + 3H2O
NaNO3 + 4Zn + 7NaOH + 6H2O = 4Na2[Zn(OH)4] + NH3↑
NaI → Na+ + I–
на катоде: 2Н2О + 2e → H2 + 2OH– 1
на аноде : 2I– – 2e → I2 1
2Н2О + 2I– H2 + 2OH– + I2
2H2O + 2NaI H2 + 2NaOH + I2
8KI + 5H2SO4(конц.) = 4K2SO4 + H2S + 4I2 + 4H2O
2NaCl 2Na + Cl2
на катоде на аноде
Na2SO4 + Ba(OH)2 = BaSO4↓ + 2NaOH
2Na2HPO4 Na4P2O7 + H2O
KNO3 + 4Mg + 6H2O = NH3 + 4Mg(OH)2 + KOH
4KClO3 KCl + 3KClO4
2KClO3 2KCl + 3O2
KClO3 + 6HCl = KCl + 3Cl2↑ + 3H2O
Na2SO3 + S = Na2S2O3
Na2S2O3 + H2SO4 = Na2SO4 + S↓ + SO2↑ + H2O
2NaI + Br2 = 2NaBr + I2
2NaBr + Cl2 = 2NaCl + Br2
I A группа.
1. Над поверхностью налитого в колбу раствора едкого натра пропускали электрические разряды, при этом воздух в колбе окрашивался в бурый цвет, который исчезает через некоторое время. Полученный раствор осторожно выпарили и установили, что твердый остаток представляет собой смесь двух солей. При нагревании этой смеси выделяется газ и остается единственное вещество. Напишите уравнения описанных реакций.
2. Вещество, выделяющееся на катоде при электролизе расплава хлорида натрия, сожгли в кислороде. Полученный продукт поместили в газометр, наполненный углекислым газом. Образовавшееся вещество добавили в раствор хлорида аммония и раствор нагрели. Напишите уравнения описанных реакций.
3) Азотную кислоту нейтрализовали пищевой содой, нейтральный раствор осторожно выпарили и остаток прокалили. Образовавшееся вещество внесли в подкисленный серной кислотой раствор перманганата калия, при этом раствор обесцветился. Азотсодержащий продукт реакции поместили в раствор едкого натра и добавили цинковую пыль, при этом выделился газ с резким запахом. Напишите уравнения описанных реакций.
4) Вещество, полученное на аноде при электролизе раствора иодида натрия с инертными электродами, внесли в реакцию с калием. Продукт реакции нагрели с концентрированной серной кислотой, и выделившийся газ пропустили через горячий раствор хромата калия. Напишите уравнения описанных реакций
5) Вещество, полученное на катоде при электролизе расплава хлорида натрия, сожгли в кислороде. Поученный продукт последовательно обработали сернистым газом и раствором гидроксида бария. Напишите уравнения описанных реакций
6) Белый фосфор растворяется в растворе едкого кали с выделением газа с чесночным запахом, который самовоспламеняется на воздухе. Твердый продукт реакции горения прореагировал с едким натром в таком соотношении, что в образовавшемся веществе белого цвета содержится один атом водорода; при прокаливании последнего вещества образуется пирофосфат натрия. Напишите уравнения описанных реакций
7) Неизвестный металл сожгли в кислороде. Продукт реакции, взаимодействует с углекислым газом, образует два вещества: твердое, которое взаимодействует с раствором соляной кислоты с выделением углекислого газа, и газообразное простое вещество, поддерживающее горение. Напишите уравнения описанных реакций.
8) Через избыток раствора едкого кали пропустили бурый газ в присутствии большого избытка воздуха. В образовавшийся раствор добавили магниевую стружку и нагрели, выделившимся газом нейтрализовали азотную кислоту. Полученный раствор осторожно выпарили, твердый продукт реакции прокалили. Напишите уравнения описанных реакций.
9) При термическом разложении соли А в присутствии диоксида марганца образовались бинарная соль Б и газ, поддерживающий горение и входящий в состав воздуха; при нагревании этой соли без катализатора образуются соль Б и соль высшей кислородсодержащей кислоты. При взаимодействии соли А с соляной кислотой выделяется желто-зеленый газ (простое вещество) и образуется соль Б. Соль Б окрашивает пламя в фиолетовый цвет, при ее взаимодействии с раствором нитрата серебра выпадает осадок белого цвета. Напишите уравнения описанных реакций.
10) К нагретой концентрированной серной кислотой добавили медную стружку и выделившийся газ пропустили через раствор едкого натра (избыток). Продукт реакции выделили, растворили в воде и нагрели с серой, которая в результате проведения реакции растворилась. В полученный раствор добавили разбавленную серную кислоту. Напишите уравнения описанных реакций.
11) Поваренную соль обработали концентрированной серной кислотой. Полученную соль обработали гидроксидом натрия. Полученный продукт прокалили с избытком угля. Выделившийся при этом газ прореагировал в присутствии катализатора с хлором. Напишите уравнения описанных реакций.
12) Натрий прореагировал с водородом. Продукт реакции растворили в воде, при этом образовался газ, реагирующий с хлором, а полученный раствор при нагревании прореагировал с хлором с образованием смеси двух солей. Напишите уравнения описанных реакций.
13) Натрий сожгли в избытке кислорода, полученное кристаллическое вещество поместили в стеклянную трубку и пропустили через неё углекислый газ. Газ, выходящий из трубки, собрали и сожгли в его атмосфере фосфор. Полученное вещество нейтрализовали избытком раствора гидроксида натрия. Напишите уравнения описанных реакций.
14) К раствору, полученному в результате взаимодействия пероксида натрия с водой при нагревании, добавили раствор соляной кислоты до окончания реакции. Раствор образовавшейся соли подвергли электролизу с инертными электродами. Газ, образовавшийся в результате электролиза на аноде, пропустили через суспензию гидроксида кальция. Напишите уравнения описанных реакций.
15) Через раствор гидроксида натрия пропустили сернистый газ до образования средней соли. К полученному раствору прилили водный раствор перманганата калия. Образовавшийся осадок отделили и подействовали на него соляной кислотой. Выделившийся газ пропустили через холодный раствор гидроксида калия. Напишите уравнения описанных реакций.
16) Смесь оксида кремния (IV) и металлического магния прокалили. Полученное в результате реакции простое вещество обработали концентрированным раствором гидроксида натрия. Выделившийся газ пропустили над нагретым натрием. Образовавшееся вещество поместили в воду. Напишите уравнения описанных реакций.
17) Продукт взаимодействия лития с азотом обработали водой. Полученный газ пропустили через раствор серной кислоты до прекращения химических реакций. Полученный раствор обработали раствором хлорида бария. Раствор профильтровали, а фильтрат смешали с раствором нитрата натрия и нагрели. Напишите уравнения описанных реакций.
18) Натрий нагрели в атмосфере водорода. При добавлении к полученному веществу воды наблюдали выделение газа и образование прозрачного раствора. Через этот раствор пропустили бурый газ, который был получен в результате взаимодействия меди с концентрированным раствором азотной кислоты. Напишите уравнения описанных реакций.
19) Гидрокарбонат натрия прокалили. Полученную соль растворили в воде и смешали с раствором алюминия, в результате образовался осадок и выделился бесцветный газ. Осадок обработали избытком раствора азотной кислоты, а газ пропустили через раствор силиката калия. Напишите уравнения описанных реакций.
20) Натрий сплавили с серой. Образовавшееся соединение обработали соляной кислотой, выделившийся газ нацело прореагировал с оксидом серы (IV). Образовавшееся вещество обработали концентрированной азотной кислотой. Напишите уравнения описанных реакций.
21) Натрий сожгли в избытке кислорода. Образовавшееся вещество обработали водой. Полученную смесь прокипятили, после чего в горячий раствор добавили хлор. Напишите уравнения описанных реакций.
22) Калий нагрели в атмосфере азота. Полученное вещество обработали избытком соляной кислоты, после чего к образовавшейся смеси солей добавили суспензию гидроксида кальция и нагрели. Полученный газ пропустили рад раскаленным оксидом меди (II).Напишите уравнения описанных реакций.
23) Калий сожгли в атмосфере хлора, образовавшуюся соль обработали избытком водного раствора нитрата серебра. Выпавший осадок отфильтровали, фильтрат выпарили т осторожно нагрели. Образовавшуюся соль обработали водным раствором брома. Напишите уравнения описанных реакций.
24) Литий прореагировал с водородом. Продукт реакции растворили в воде, при этом образовался газ, реагирующий с бромом, а полученный раствор при нагревании прореагировал с хлором с образованием смеси двух солей. Напишите уравнения описанных реакций.
25) Натрий сожгли на воздухе. Образовавшееся при этом твердое вещество поглощает углекислый газ с выделением кислорода и соли. Последнюю соль растворили в соляной кислоте, а к полученному при этом раствору добавили раствор нитрата серебра. При этом выпал белый осадок. Напишите уравнения описанных реакций.
26) Кислород подвергли воздействию электроразряда в озонаторе. Полученный газ пропустили через водный раствор йодида калия, при этом выделился новый газ без цвета и запаха, поддерживающий горение и дыхание. В атмосфере последнего газа сожгли натрий, а полученное при этом твердое вещество прореагировало с углекислым газом. Напишите уравнения описанных реакций.
I A группа.
1. N2 + O22NO
2NO + O2 = 2NO2
2NO2 + 2NaOH = NaNO3 + NaNO2 + H2O
2NaNO3 2NaNO2 + O2
2. 2NaCl 2Na + Cl2
на катоде на аноде
2Na + O2 = Na2O2
2Na2O2 + 2CO2 = 2Na2CO3 + O2
Na2CO3 + 2NH4Cl = 2NaCl + CO2 + 2NH3 + Н2О
3. NaHCO3 + HNO3 = NaNO3 + CO2 + H2O
2NaNO3 2NaNO2 + O2
5NaNO2 + 2KMnO4 + 3H2SO4 = 5NaNO3 + 2MnSO4 + K2SO4 + 3H2O
NaNO3 + 4Zn + 7NaOH + 6H2O = 4Na2[Zn(OH)4] + NH3↑
4. 2H2O + 2NaI H2 + 2NaOH + I2
2K + I2 = 2KI
8KI + 5H2SO4(конц.) = 4K2SO4 + H2S + 4I2 + 4H2O
3H2S + 2K2CrO4 + 2H2O = 2Cr(OH)3↓ + 3S↓ + 4KOH
5. 2NaCl 2Na + Cl2
на катоде на аноде
2Na + O2 = Na2O2
Na2O2 + SO2 = Na2SO4
Na2SO4 + Ba(OH)2 = BaSO4↓ + 2NaOH
6. P4 + 3KOH + 3H2O = 3KH2PO2 + PH3↑
2PH3 + 4O2 = P2O5 + 3H2O
P2O5 + 4NaOH = 2Na2HPO4 + H2O
2Na2HPO4 Na4P2O7 + H2O
7. 2Na + O2 Na2O2
2Na2O2 + 2CO2 = 2Na2CO3 + O2↑
Na2CO3 + 2HCl = 2NaCl + CO2 + H2O
C + O2 = CO2
8. 2KOH + 2NO2 + O2 = 2KNO3 + H2O
KNO3 + 4Mg + 6H2O = NH3 + 4Mg(OH)2 + KOH
NH3 + HNO3 = NH4NO3
NH4NO3N2O + 2H2O (190 – 245°C)
2NH4NO32NO + N2 + 4H2O (250 – 300°C)
2NH4NO32N2 + О2 + 4H2O (выше 300°C)
9. 2KClO3 2KCl + 3O2 ↑
4KClO3 KCl + 3KClO4
KClO3 + 6HCl = KCl + 3Cl2↑ + 3H2O
KCl + AgNO3 = AgCl↓ + KNO3
10. 2H2SO4(конц.) + Cu = CuSO4 + SO2 ↑ + 2H2O
SO2 + 2NaOH = Na2SO3 + H2O
Na2SO3 + S = Na2S2O3
Na2S2O3 + H2SO4 = Na2SO4 + S↓ + SO2↑ + H2O
11. NaCl(тверд.) + H2SO4(конц.) = NaHSO4 + HCl↑
NaHSO4 + NaOH = Na2SO4 + H2O
Na2SO4 + 4C Na2S + 4CO↑
CO + Cl2 COCl2
12) 2Na + H2 = 2NaH
NaH + H2O = NaOH + H2↑
H2 + Cl2 = 2HCl
6NaOH + 3Cl2 = NaClO3 + 5NaCl + 3H2O
13) 2Na + O2 = Na2O2
2Na2O2 + 2CO2 = 2Na2CO3 + O2↑
4P + 5O2 = 2P2O5
P2O5 + 6NaOH = 2Na3PO4 + 3H2O
14) 2Na2O2 + 2H2O = 4NaOH + O2↑
NaOH + HCl = NaCl + H2O
2H2O + 2NaCl H2↑ + 2NaOH + Cl2↑
2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O
15) 2NaOH + SO2 = Na2SO3 + H2O
3Na2SO3 + 2KMnO4 + H2O = 3Na2SO4 + 2MnO2 + 2KOH
MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O
2NaOH(холодный) + Cl2 = NaCl + NaClO + H2O
16) SiO2 + 2Mg = 2MgO + Si
2NaOH + Si + H2O = Na2SiO3 + 2H2
2Na + H2 = 2NaH
NaH + H2O = NaOH + H2
17) 6Li + N2 = 2Li3N
Li3N + 3H2O = 3LiOH + NH3
2NH3 + H2SO4 = (NH4)2SO4
(NH4)2SO4 + BaCl2 = BaSO4 + 2NH4Cl
18) 2Na + H2 = 2NaH
NaH + H2O = NaOH + H2
Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2 + 2H2O
2NaOH + 2NO2 = NaNO3 + NaNO2 + H2O
19) 2NaHCO3 Na2CO3 + CO2 + H2O
3Na2CO3 + 2AlBr3 + 3H2O = 2Al(OH)3↓ + 3CO2↑ + 6NaBr
Al(OH)3 + 3HNO3 = Al(NO3)3 + 3H2O
К2SiO3 + 2CO2 + 2H2O = 2КHCO3 + H2SiO3↓
20) 2Na + S = Na2S
Na2S + 2HCl = 2NaCl + H2S↑
SO2 + 2H2S = 3S + 2H2O
S + 6HNO3 = H2SO4 + 6NO2 + 2H2O
21) 2Na + O2 = Na2O2
Na2O2 + 2H2O = 2NaOH + H2O2
2H2O2 2H2O + O2
6NaOH (гор.) + 3Cl2 = NaClO3 + 5NaCl + 3H2O
22) 6K + N2 = 2K3N
K3N + 4HCl = 3KCl + NH4Cl
2NH4Cl + Ca(OH)2 = CaCl2 + 2NH3 + 2H2O
2NH3 + 3CuO = N2 + 3Cu + 3H2O
23) 2K + Cl2 = 2KCl
KCl + AgNO3 = KNO3 + AgCl↓
2KNO3 2KNO2 + O2
KNO2 + Br2 + H2O = KNO3 + 2HBr
24) 2Li + H2 = 2LiH
LiH + H2O = LiOH + H2
H2 + Br2 = 2HBr
6LiOH(гор.) + 3Cl2 = LiClO3 + 5LiCl + 3H2O
25) 2Na + O2 = Na2O2
2Na2O2 + 2CO2 = 2Na2CO3 + O2↑
Na2CO3 + 2HCl = 2NaCl + CO2↑ + H2O
NaCl + AgNO3 = AgCl↓ + NaNO3
26) 3O2 ↔ 2O3
O3 + 2KI + H2O = I2 + O2↑ + 2KOH
2Na + O2 = Na2O2
2Na2O2 + 2CO2 = 2Na2CO3 + O2↑
studfiles.net
общая характеристика, строение; свойства и получение простых веществ — урок. Химия, 8–9 класс.
Щелочными металлами называются химические элементы-металлы \(IA\) группы Периодической системы Д. И. Менделеева: литий \(Li\), натрий \(Na\), калий \(K\), рубидий \(Rb\), цезий \(Cs\) и франций \(Fr\).
Электронное строение атомов. На внешнем энергетическом уровне атомы щелочных металлов имеют один электрон ns1. Поэтому для всех металлов группы \(IA\) характерна степень окисления \(+1\).
Этим объясняется сходство свойств всех щелочных металлов.
Для них (сверху вниз по группе) характерно:
- увеличение радиуса атомов;
- уменьшение электроотрицательности;
- усиление восстановительных, металлических свойств.
Нахождение в природе. Из щелочных металлов наиболее широко распространены в природе натрий и калий. Но из-за высокой химической активности они встречаются только в виде соединений.
Основными источниками натрия и калия являются:
- каменная соль (хлорид натрия \(NaCl\)),
- глауберова соль, или мирабилит — декагидрат сульфата натрия Na2SO4 \(·\) 10h3O,
- сильвин — хлорид калия \(KCl\),
- сильвинит — двойной хлорид калия-натрия \(KCL\) \(·\)\(NaCl\) и др.
Соединения лития, рубидия и цезия в природе встречаются значительно реже, поэтому их относят к числу редких и рассеянных.
Физические свойства простых веществ. В твёрдом агрегатном состоянии атомы связаны металлической связью. Наличие металлической связи обусловливает общие физические свойства простых веществ-металлов: металлический блеск, ковкость, пластичность, высокую тепло- и электропроводность.
В свободном виде простые вещества, образованные элементами \(IA\) группы — это легкоплавкие металлы серебристо-белого (литий, натрий, калий, рубидий) или золотисто-жёлтого (цезий) цвета, обладающие высокой мягкостью и пластичностью.

Наиболее твёрдым является литий, остальные щелочные металлы легко режутся ножом и могут быть раскатаны в фольгу.
Только у натрия плотность немного больше единицы ρ=1,01 г/см3, у всех остальных металлов плотность меньше единицы.
Химические свойства. Щелочные металлы обладают высокой химической активностью, реагируя с кислородом и другими неметаллами.
Поэтому хранят щелочные металлы под слоем керосина или в запаянных ампулах. Они являются сильными восстановителями.
Все щелочные металлы активно реагируют с водой, выделяя из неё водород.
Пример:
2Na+2h3O=2NaOH+h3↑.
Взаимодействие натрия с водой протекает с выделением большого количества теплоты (т. е. реакция является экзотермической). Кусочек натрия, попав в воду, начинает быстро двигаться по её поверхности. Под действием выделяющейся теплоты он расплавляется, превращаясь в каплю, которая, взаимодействуя с водой, быстро уменьшается в размерах. Если задержать её, прижав стеклянной палочкой к стенке сосуда, капля воспламенится и сгорит ярко-жёлтым пламенем.
Получение. Металлический натрий в промышленности получают главным образом электролизом расплава хлорида натрия с инертными (графитовыми) электродами.
В расплаве хлорида натрия присутствуют ионы:
NaCl⇄Na++Cl−.
При электролизе
на катоде восстанавливаются катионы Na+, а на аноде окисляются анионы Cl−:
катод (\(–\)): 2Na++2e=2Na,
анод (\(+\)): 2Cl−−2e=Cl2↑.
Суммарное уравнение реакции при электролизе расплава хлорида натрия:
2NaCl→2Na+Cl2↑.
Источники:
Иллюстрация: https://arhivurokov.ru/multiurok/html/2017/02/26/s_58b332582fb94/img1.jpg
www.yaklass.ru
Щелочные металлы в химии
К щелочным металлам относятся металлы IA группы Периодической системы Д.И. Менделеева – литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). На внешнем энергетическом уровне щелочных металлов находится один валентный электрон. Электронная конфигурация внешнего энергетического уровня щелочных металлов – ns1. В своих соединениях они проявляют единственную степень окисления равную +1. В ОВР являются восстановителями, т.е. отдают электрон.
Физические свойства щелочных металлов
Все щелочные металлы легкие (обладают небольшой плотностью), очень мягкие (за исключением Li легко режутся ножом и могут быть раскатаны в фольгу), имеют низкие температуры кипения и плавления (с ростом заряда ядра атома щелочного металла происходит понижение температуры плавления).
В свободном состоянии Li, Na, K и Rb – серебристо-белые металлы, Cs – металл золотисто-желтого цвета.
Щелочные металлы хранят в запаянных ампулах под слоем керосина или вазелинового масла, поскольку они обладают высокой химической активностью.
Щелочные металлы обладают высокой тепло- и электропроводностью, что обусловлено наличием металлической связи и объемоцентрированной кристаллической решетки
Получение щелочных металлов
Все щелочные металлы возможно получить электролизом расплава их солей, однако на практике таким способом получают только Li и Na, что связано с высокой химической активностью K, Rb, Cs:
2LiCl = 2Li + Cl2↑
2NaCl = 2Na + Cl2↑
Любой щелочной металл можно получить восстановлением соответствующего галогенида (хлорида или бромида), применяя в качестве восстановителей Ca, Mg или Si. Реакции проводят при нагревании (600 – 900С) и под вакуумом. Уравнение получения щелочных металлов таким способом в общем виде:
2MeCl + Ca = 2Mе↑ + CaCl2,
где Ме – металл.
Известен способ получения лития из его оксида. Реакцию проводят при нагревании до 300°С и под вакуумом:
2Li2O + Si + 2CaO = 4Li + Ca2SiO4
Получение калия возможно по реакции между расплавленным гидроксидом калия и жидким натрием. Реакцию проводят при нагревании до 440°С:
KOH + Na = K + NaOH
Химические свойства щелочных металлов
Все щелочные металлы активно взаимодействуют с водой образуя гидроксиды. Из-за высокой химической активности щелочных металлов протекание реакции взаимодействия с водой может сопровождаться взрывом. Наиболее спокойно с водой реагирует литий. Уравнение реакции в общем виде:
2Me + H2O = 2MeOH + H2↑
где Ме – металл.
Щелочные металлы взаимодействуют с кислородом воздуха образую ряд различных соединений – оксиды (Li), пероксиды (Na), надпероксиды (K, Rb, Cs):
4Li + O2 = 2Li2O
2Na + O2 =Na2O2
K + O2 = KO2
Все щелочные металлы при нагревании реагируют с неметаллами (галогенами, азотом, серой, фосфором, водородом и др.). Например:
2Na + Cl2 =2NaCl
6Li + N2 = 2Li3N
2Li +2C = Li2C2
2K + S = K2S
2Na + H2 = 2NaH
Щелочные металлы способны взаимодействовать со сложными веществами (растворы кислот, аммиак, соли). Так, при взаимодействии щелочных металлов с аммиаком происходит образование амидов:
2Li + 2NH3 = 2LiNH2 + H2↑
Взаимодействие щелочных металлов с солями происходит по следующему принципу –вытесняют менее активные металлы (см. ряд активности металлов) из их солей:
3Na + AlCl3 = 3NaCl + Al
Взаимодействие щелочных металлов с кислотами неоднозначно, поскольку при протекании таких реакций металл первоначально будет реагировать с водой раствора кислоты, а образующаяся в результате этого взаимодействия щелочь будет реагировать с кислотой.
Щелочные металлы реагируют с органическими веществами, такими, как спирты, фенолы, карбоновые кислоты:
2Na + 2C2H5OH = 2C2H5ONa + H2↑
2K + 2C6H5OH = 2C6H5OK + H2↑
2Na + 2CH3COOH = 2CH3COONa + H2↑
Качественные реакции
Качественной реакцией на щелочные металлы является окрашивание пламени их катионами: Li+ окрашивает пламя в красный цвет, Na+ — в желтый, а K+, Rb+, Cs+ — в фиолетовый.
Примеры решения задач
ru.solverbook.com
Соединения щелочных металлов
Оксиды — белые кристаллические вещества, энергично растворяющиеся в воде с образованием щелочей:
Na2O + H2O = 2NaOH
Реагируют с кислотными и амфотерными оксидами с образованием солей. Получают оксид лития прямым синтезом, оксиды других металлов восстановлением пероксида:
Na2O2 + 2Na = 2Na2O
Пероксиды щелочных металлов термически неустойчивы, при нагревании разлагаются:
t
2Na2O2 = 2Na2O + O2
Реагируют с водой и диоксидом углерода:
Na2O2 + 2H2O = 2NaOH + H2O2; 2Na2O2 + 2CO2 = 2Na2CO3 + O2
Последняя реакция используется для регенерации воздуха.
Надпероксиды образуются в результате прямого синтеза только для металлов подгруппы калия. Представляют собой кристаллические вещества желтого цвета, очень реакционноспособны:
2КO2 + 2H2O = 2КOH + Н2O2 + O2;
Озониды — красные кристаллические вещества, получают пропуская озон через расплав гидроксида:
4КOН + 4O3 = 4KO3 + O2 + 2Н2O
Озониды неустойчивы, бурно разлагаются водой:
2KO3 = 2KO2 + O2 ; 4KO3 + 2Н2O = 4КOН + 5O2
Гидроксиды щелочных металлов получают взаимодействием их оксидов с водой, электролизом водных растворов хлоридов или взаимодействием карбонатов с известковым молоком (суспензией гидроксида кальция в воде):
эл.ток
2NaCl + 2H2O = 2NaOH + H2 + Cl2; Na2CO3 + Ca(OH)2 = CaCO3 + 2NaOH
Гидроксиды хорошо растворимы в воде, сильные основания, термически устойчивы, возгоняются без разложения. Исключение составляет гидроксид лития:
t
2LiOH = Li2O + H2O
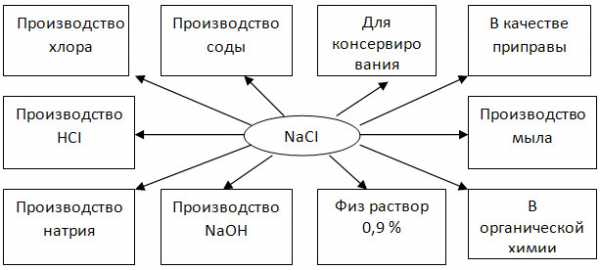
Гидроксид лития используется как электролит для щелочных аккумуляторов. Некоторые соли лития используют в медицине для растворения мочевой кислоты при подагре и как психотропные препараты. Гидроксид натрия используюь при производстве целлюлозы, мыла, очистке растительного масла и нефти. Гидроксид калия применяется при производстве жидкого мыла, очистке и осушке газов и растворителей.
Щелочные металлы образуют соли со всеми известными кислотами. Соли щелочных металлов, за исключением солей лития, обычно хорошо растворимы в воде. Малорастворимыми солями лития являются: фосфат, карбонат, фторид. Малорастворимы в воде Na[Sb(OH)6], KClO4, K2[PtCl6], K3[Co(NO2)6], RbClO4, CsClO4. Соли щелочных металлов окрашивают пламя в характерные цвета: литий — в карминово-красный, натрий — в желтый, калий — в фиолетовый.
Соли щелочных металлов термически устойчивы, исключение составляют соли лития, которые разлагаются при нагревании аналогично солям магния. Например:
Li2СО3 = Li2O + СО2; 4LiNO3 = 2Li2O + 4NO2 + O2
Хлорид натрия широко используется как консервант и вкусовая добавка. Нитрат натрия (натриевая селитра) — азотное удобрение. Хлорид, нитрат, карбонат и сульфат калия используют в качестве калийных удобрений. Соли рубидия — снотворные и болеутоляющие препараты, применяются при лечении некоторых форм эпилепсии.
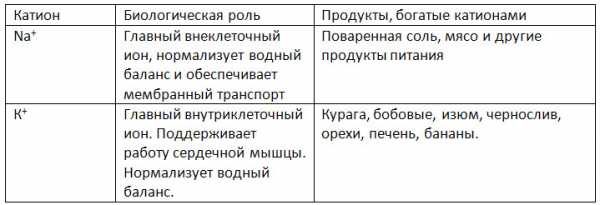
В организме животных и человека катионы натрия и калия играют важную роль (натрий-калиевый насос). В организме животных катионы калия обеспечивают проводимость нервного импульса, регулируют работу ферментов. Катионы калия активируют в растениях синтез органических веществ, особенно углеводов, и обеспечивают тургор тканей.
Гидриды получают нагреванием щелочного металла в атмосфере водорода:
t
2Na + H2 = 2NaH
Представляют собой бесцветные, солеподобные вещества, легко разлагаются водой, эффективные восстановители.
NaH + H2О = NaОH + H2
studfiles.net
Тема 13. Соединения щелочных металлов.
Часть I
1. Оксиды – M2O.
1) Тип связи – ионная.
Схема ее образования:
Тип кристаллической решетки: ионная.
2) Характер оксидов – основный.
Химические свойства оксидов:
а) M2 O + кислотный оксид→соль
б) M2 O + h3O → щелочь
в) M2 O + HNO3→ соль MNO3 + h3O
3) Получение:
а) 4LI + O2→2Li2O;
б) Na→X→Na2O.
Запишите уравнения соответствующих реакций.
2Na + O2→Na2O2
Na2O2 + 2Na→2Na2O
2. Гидроксиды МОН.
1) Тип кристаллической решетки – ионный. Состоят из катионов М+ и анионов ОН-. Физические свойства: твердые белые вещества, гигроскопичны.
Растворы – это щелочи.
2) Химические свойства (составьте уравнения возможных реакций – молекулярные, полные и сокращенные ионные):
а) пример реакции нейтрализации:
б) Взаимодействуют с кислотными оксидами.
в) Взаимодействуют с солями, если образуется осадок:
г) взаимодействует с солями, если образуется газ:
д) Взаимодействуют с амфотерными оксидами:
е) Взаимодействует с амфотерными гидроксидами.
3) Получение:
a) 2M + 2HOH→2MOH + h3
б) M2O + HOH→2MOH
4) Заполните таблицу «Щелочи и их применение».
3. Соли имеют ионную кристаллическую решетку.
Заполните таблицу «Названия и применение солей металлов IA группы».
4. Заполните таблицу «Окрашивание пламени ионами щелочных металлов».
Часть II
1. Заполните таблицу «Биологическая роль катионов натрия и калия».
2. Дополните цепочку переходов. Запишите уравнения реакций, с помощью которых можно осуществить превращения по схеме:

3. Заполните схему «Области применения хлорида натрия».
4. Для соединения NaH укажите:
1) Название гидрид натрия
2) Тип связи и кристаллическую решетку — ионная связь, ионная кристаллическая решетка
3) Схему образования связи на основе реакции получения (синтеза) 2Na + h3→ 2NaН.
4) Уравнение реакции взаимодействия с водой (рассмотрите ОВР)
5. Пероксид натрия Na2O2 имеет структурную формулу:
Na – O – O – Na.
Укажите тип связи между атомами:
а) натрия и кислорода ионная
б) кислорода и кислорода ковалентная неполярная
Наличие разных типов связи в одном соединении говорит о единой природе химической связи.
6. По образцу сочинения, приведённого в заданиях учебного параграфа, напишите сочинение на тему «Художественный образ соединения щелочного металла» в особой тетради.
superhimik.ru
| 1. |
Щелочные металлы
Сложность: лёгкое |
1 |
| 2. |
Щёлочи
Сложность: лёгкое |
2 |
| 3. |
Общая характеристика щелочных металлов
Сложность: среднее |
2 |
| 4. |
Химические свойства щелочных металлов и их оксидов
Сложность: среднее |
4 |
| 5. |
Химические свойства щелочей
Сложность: среднее |
4 |
| 6. |
Соли натрия
Сложность: среднее |
3 |
| 7. |
Соли калия
Сложность: среднее |
3 |
| 8. |
Общая характеристика щелочных металлов
Сложность: среднее |
4 |
| 9. |
Электролиз расплавов солей натрия и калия
Сложность: среднее |
6 |
| 10. |
Химические свойства щелочных металлов и их соединений
Сложность: среднее |
6 |
www.yaklass.ru