Ртуть, электропроводность — Справочник химика 21
Простые вещества по свойствам составляющих их элементов делятся на металлы и неметаллы. Металлы имеют ряд общих свойств. Это — металлический блеск, высокая теплопроводность и электропроводность. Бее металлы, кроме ртути, при нормальных условиях (температура 0°С, давление 1 атм.) являются твердыми веществами, прочными и пластичными. Металлы обладают более высокими восстановительными свойствами, чем неметаллы. Подробнее о металлах и неметаллах разговор пойдет в главе 2 и в главе 7, В приведенной на форзаце Периодической системе элементов разными цветами выделены типичные металлы и неметаллы. [c.10]Наиболее изученный из всех четырех элементов — лантан — проводит электрический ток почти вдвое лучше ртути. Электропроводность иттрия и скандия немного ниже. [c.228]
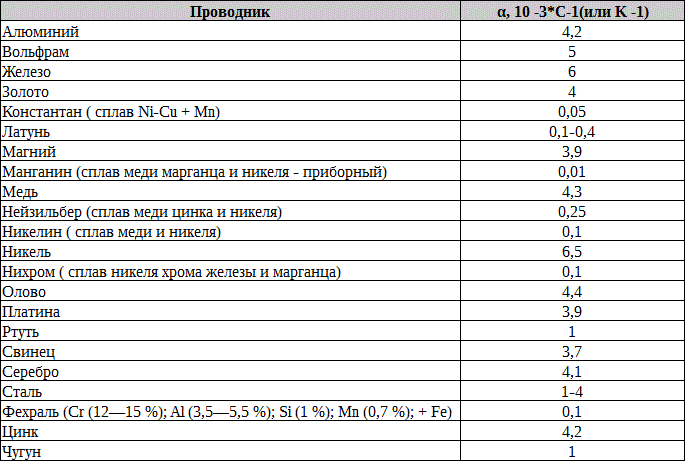
Способность тел проводить электричество называется их электропроводностью. Если принять электропроводность ртути при 0° С равной 1, то для других тел она выразится следующим образом
Здесь и далее электропроводность ртути принята за единицу. [c.277]
Электропроводность расплавленных солей, как правило, с температурой увеличивается (исключение составляют соли ртути, индия и некоторые другие). Особенно быстро увеличивается электропроводность при температурах, незначительно превышающих температуры плавления. [c.452]
Металлы — хорошие проводники тепла и электричества. При прохождении электрического тока через металлические проводники не происходит переноса частиц металла (электронная проводимость, или проводимость первого рода). По способности проводить тепло и электричество металлы располагаются приблизительно в одном и том же порядке лучшие проводники —серебро и медь, затем золото, алюминий, железо и худшие —свинец и ртуть. Следовательно, между теплопроводностью металлов и их электропроводностью наблюдается почти постоянное соотношение. [c.297]
Конвективный ток зарядов внутренней обкладки замыкается омическим током, который течет внутра капли ртути. Электропроводность ртути велика по сравнению с электропроводностью раствора, поэтому возникающим падением потенциала можно пренебречь. Это условие [c.500]
Существенные сведения относительно природы химической связи в металлах можно получить на основании двух характерных особенностей по сравнению с ковалентными и ионными соединениями. Металлы, во-первых, отличаются от других веществ высокой электропроводностью и теплопроводностью, во-вторых, в обычных условиях являются кристаллическими веществами (за исключением ртути), структуры которых характеризуются высокими координационными числами. [c.104]
Ка —> Ка+ + е НгО + е —> ОН + 1/2Н2 В результате разложения образуются едкий натр и водород. Вследствие высокого перенапряжения водорода на ртути процесс протекает очень медленно. Для ускорения процесса разложения амальгаму натрия необходимо ввести в контакт с металлом или другим электропроводным материалом, имеющим низкое перенапряжение водорода. Металл и амальгама образуют короткозамкнутый элемент, при работе которого водород будет выделяться на металле, а натрий переходить в раствор.
Электропроводность расплавленной ионной соли обычно на один-два порядка превышает электропроводность водного раствора того же электролита. Так, например, удельная электропроводность расплава КС1 при 800°С равна 24,2 См/м, тогда как удельная электропроводность водного раствора хлорида калия Проводимость расплавов остается, однако, на 3—4 порядка ниже проводимости жидких металлов, например ртути. Для сравнения электропроводности различных расплавленных солей, как и водных растворов, используют эквивалентную электропроводность. Однако при рассмотрении расплавов возникает проблема, связанная с сильной зависимостью Л от температуры и с необходимостью выбора соответствующей температуры сравнения, тем более что температуры плавления разных веществ существенно отличны. Особенно резкое изменение электропроводности происходит вблизи температуры плавления, так как при плавлении разрушается (диссоциирует) ионная решетка. Обычно сравнивают величины Л при абсолютных температурах, превышающих на 10% абсолютную температуру плавления. При этом, по-видимому, наступает практически полная диссоциация кристаллической решетки. [c.90]
Здесь и далее условно за единицу электропроводности принята электропроводность ртути. [c.372]
Лантаноиды ковки, имеют относительно невысокую твердость, по электропроводности сходны с ртутью. [c.551]
Металлические решетки образуют простые вещества большинства элементов периодической системы — металлы. По прочности. металлические решетки находятся между атомными и молекулярными кристаллическими решетками. Это связано с тем, что металлической связи присущи и характерные черты ковалентной связи, и отдельные черты дальнодействующей связи. Металлические решетки бывают и малопрочные, например, ртуть — жидкая. Металлам свойственны непрозрачность, характерный металлический блеск, хорошая тепло- и электропроводность и другие характерные свойства. Упрощенно металлическая решетка представляется в виде положительно заряженных ионов, располагающихся в узлах ее, и электронов, двигающихся между ними. Атомы металлов, с характерным для них дефицитом валентных электронов, должны иметь как можно больше соседних атомов, чтобы этот дефицит компенсировать за счет электронов соседей. Поэтому координационное число здесь достигает больших значений (8—12).
По физическим свойствам все металлы — твердые вещества (кроме ртути, которая при обычных условиях жидкая), они отличаются от неметаллов особым видом связи (металлическая связь). Валентные электроны слабо связаны с конкретным атомом и внутри каждого металла существует так называемый электронный газ. Поэтому все металлы обладают высокой электропроводностью (т. е. они — проводники в отличие от неметаллов-диэлектриков), особенно медь, серебро, золото, ртуть и алюминий высока и теплопроводность металлов. Отличительным свойством многих металлов является их пластичность (ковкость), вследствие чего они могут быть прокатаны в тонкие листы (фольгу) и вытянуты в проволоку (олово, алюминий и др.), однако встречаются и достаточно хрупкие металлы (цинк, сурьма, висмут). [c.157]
Измерение электропроводности растворов уксуснокислых солей ртути, меди и других тяжелых металлов показывает, что такие соли очень мало диссоциируют. Это характеризует наличие прочной химической связи между анионом СН3СОО и катионом. Образуют,иеся соли или более сложные по составу соединения диссоциируют часто также мало, и в этом отношении подобны комплексным аммиакатам ионов металлов и другим комплексным соединениям. Таким образом, солеобразующая группа — СООН является в то же время и комплексообразующей группой, причем образование комплексных групп происходит одновременно с замещением иона водорода на ион металла. Поэтому состояние равновесия существенно зависит от кислотности раствора.
Они обладают очень хорошей удельной электропроводностью электропроводность лития в 10,9, натрия — в 22, калия — в 15, рубидия — в 8 и цезия — в 5,2 раза больше электропроводности ртути (при 0 С). Несмотря на это, натрий как проводник далеко уступает лучшему проводнику — серебру, по отношению к которому сопротивление натрия в три раза больше. [c.232]
Физические свойства. Ртуть представляет собой серебристо-белый жидкий металл. Физические константы ее приведены в табл. 121. Удельная электропроводность ртути при 0° С равна 58% электропроводности серебра. Электропроводность ртути является стандартной единицей сопротивления — столбик ртути сечением в 1 мм и длиной в 106,3 см оказывает сопротивление в 1 ом. Молекулы ртути в парах моноатомны. [c.424]
Электропроводность а-марганца примерно в 3 раза ниже, а жидкого — примерно в 2,5 раза выше, чем у ртути (при обычных условиях). Как видно из рис. V11-24, аллотропия марганца отчетливо сказывается на характере изменения его электропроводности (и на растворимости в нем водорода). [c.301]
Графит хорошо проводит тепло (в 3 раза лучше ртути) и обладает близкой к металлам электропроводностью (0,1 от электропроводности ртути). И электро- и теплопроводность больше параллельно слоям, чем перпендикулярно им. Максимум теплопроводности графита наблюдается около 0°С, а электропроводности — около 600 °С. Механическая прочность графита при переходе от обычных температур к 2500 °С возрастает почти вдвое. Его сжимаемость примерно в 20 раз больше сжимаемости алмаза. Заметное окисление графита при нагревании на воздухе наступает лишь выше 700 С. [c.502]
Электропроводность расплавленных солей, за исключением некоторых (соли ртути и индия), с температурой увеличивается. Особенно быстро увеличивается электропроводность при температурах, незначительно превышающих температуру плавления. В табл. 14.6 приведены удельные электропроводности некоторых [c.313]
Атомы металлов в твердой и жидкой фазах образуют в основном плотноупакованные структуры. При плавлении металлов электропроводность а обычно падает примерно в 1,5—2 раза. При повышении температуры жидкого металла электропроводность уменьшается, но медленнее, чем у твердых металлов. В жидких свинце и висмуте электропроводность почти не зависит от температуры, а у жидких цинка, кадмия и ртути она даже растет с увеличением температуры. Число электронов проводимости в единице объема жидких металлов часто почти совпадает с числом валентных электронов. Подвижность электронов в металлах, как было показано А. Р. Регелем [7], при плавлении меняется мало. Плотность жидких металлов меняется при их затвердевании незначительно. Сжимаемость жидких металлов, как и твердых, мала. Она примерно на порядок меньше сжимаемости жидких диэлектриков. [c.169]
Хотя среднее число почти свободных электронов на один атом у всех металлов подгруппы цинка близко к двум, поведение электронов ртути во многом аномально. Ее электропроводность почти в три раза меньше, чем у цинка и кадмия, и быстро растет с увеличением давления. Термоэлектродвижущая сила ртути тоже аномально велика. [c.197]
Связи между атомами углерода одной и той же плоскости в решетке графита имеют типичный ковалентный характер. Отдельные плоскости связаны друг с другом в основном межмолекулярными силами, но отчасти между ними действуют и металлические связи (примерно один свободный электрон на 18 тыс. атомов углерода). Наличием последних обусловлена высокая электропроводность графита (0,1 от электропроводности ртути) и его хорошая теплопроводность (в три раза больше, чем у ртути).
Электропроводность тория примерно в 5 раз, а урана в 3 раза выше электропроводности ртути. [c.370]
В случае использования активных веществ с низкой электропроводностью для повышения коэффициента использования применяется электропроводная добавка графита и сажи, которая образует токоотвод от большинства частиц активного вещества. Подобные добавки используются в активных массах, содержащих окись ртути, двуокись марганца. [c.30]
Для протекания токообразующей реакции необходимо поступление электронов к каждой частице окиси ртути, которая имеет очень низкую электропроводность в отличие от обычно применяемых разновидностей двуокиси марганца. Электропро- щ водной добавкой, обеспечивающей подвод электронов при разрядке к каждой частице окиси ртути, является графит. [c.252]
Примером синтеза прямой конденсацией может служить получение золя ртути. Для этого Нордлунд пропускал пары ртути через слой воды и. получал довольно высокодисперсную эмульсию ртутц в воде. Аналогичным способом могут быть получены золн серы, селена и теллура. Путем конденсации в жидкости паров меди, серебра, золота и платины,. полученных в вольтовой дуге, можно получить соответствующие золи в воде, спиртах, глицерине или бензоле. Строение мицелл этих золей мало изучено. Стабилизатором при получении всех этих систем служат окислы веществ, получающиеся при соприкосновении их паров с воздухом при высокой температуре. Образование в таких условиях окислов, обладающих свойствами электролитов, подтверждается заметным возрастанием электропроводности системы. Однако более стойкие-золи получаются в том случае, если в воду, в которой происходит конденсация паров, вводят стабилизующие электролиты. [c.245]
Свойства металлов з- и р-элементов. Как известно, металлическая связь является многоцентровой, многоэлектронной и нелока-лизованной связью. Металлы отличаются тем, что у них по-разному заполнены электронами валентные энергетические зоны и зоны проводимости. -Металлы хорошие проводники электрического тока. Электрбпроводность р-металлов, как правило, много ниже. Так, натрий проводит ток примерно в 20 раз, олово в 6,7 раза, а сурьма только в 2,5 раза лучше ртути, электропроводность которой равна 1,06-10 ° мк-0м-м2 (273 К). [c.400]
Металлы отличаются характерным металлп геским блеском, ковкостью, тягучестью, могут прокатываться в листы или вытягиваться в нроволому, обладают хорошей тепло- и электропроводностью. При компатноп температуре все металлы (кроме ртути) находятся в твердом состоянии. [c.39]
Активная масса положительного электрода состоит из к15асной окиси ртути, к которой для повышения электропроводности добавляют 5—107о графита. Эту смесь запрессовывают в стальной корпус элемента. В одном из видов окиснортутных элементов активную массу отрицательного электрода составляет порошок цинка с добавкой / 1% ртути, которые запрессовывают в крышку элемента. Между электродами прокладывают фильтровальную бумагу. В качестве электролита (в виде геля или жидкости) применяют 36—40%-ный раствор едкого кали с добавкой 5% окиси цинка. В другом виде oки нopтytныx элементов отрицательным электродом служит металлизированная цинком бумага или фольга из амаль-гам.ированного цинка. Применение электродов с большой поверхностью (из порошкообраз ного цинка или фольги) вызвано необходимостью уменьшить пассивацию цинка. [c.877]
Из уравнения (38.7) видно, что скорость движения поверхности ртути падает при увеличении электропроводности раствора. Из соотношения (38.7) и условия (ЭУ//( е = О можно рассчитать заряд Втах, при котором ток максимален [c.207]
Хорошо известны меркаптиды (тиолаты) тяжелых металлов. Из них наиболее распространены соли ртути, меди, серебра, висмута, олова и свинца. Соли свинца, например, издавна используются в зарубежной практике для очистки бензинов от меркаптанов ( докторские растворы ). Меркаптиды серебра могут быть использованы для получения серебряных поверхностей с хорошей электропроводностью на керамике. Имеются сведения о применении фторсодержащих меркаптанов в виде защитных пленок, предохраняющих металлы от атмосферной коррозии. Металлические соли некоторых аминомеркантаносоединений применяются в качестве, медицинских препаратов. [c.29]
Электропроводность рения в 4,5 раза выше, чем у ртути, и при обучных температурах в 4 раза меньше, чем у вольфрама (при 2500 °С—в 1,6 раза меньше). Металл этот пригоден для изготовления нитей электроламп, более прочных и долговечных, чем обычные вольфрамовые. Рений является также хорошим катализатором некоторых органических реакций. В виде сплава с платиной он применяется для изготовления термоэлементов. [c.301]
В кристаллическом состоянии кремний хорощо проводит тепло. Его электропройодность составляет 0,007 (для обычного) —0,000001 (для особо чистого) от электропроводности ртути, причем при нагревании она не понижается (как то характерно для металлов), а повышается. Повышается она и с увеличением давления, а при 120 тыс. ат кремний приобретает свойства металла. Теплота плавления кремния равна II, теплота атомизации — 108 ккал1г-атом. [c.587]
Плотность, г/см Твердость по шкале Моося Тпл, К КИП к Электропроводность (293 К) (здесь и далее относительнв ртути) 0,5 0,6 453 1613 11,2 1,8 4 1558 2743 15,1 [c.401]
Если в качестве критерия ирименягь электропроводность водных растворов, сильными электролитами оказываются почти все соли, щелочи и сильные кислоты. Слабые кислоты и основания, а также некоторые соли [хлорид ртути (II), бромид кадмия и др.] представляют собой слабые электролиты. При изменении раство- [c.27]
chem21.info
Электропроводность — ртуть — Большая Энциклопедия Нефти и Газа, статья, страница 2
Электропроводность — ртуть
Cтраница 2
В отличие от алмаза графит является хорошим проводником тепла и электрического тока, сравнимым с металлами. Монокристаллы графита имеют электропроводность, вдвое превышающую электропроводность ртути. [16]
Литий — весьма пластичный металл с очень высоким значением удлинения, легко обрабатывается прокаткой, волочением, ковкой, штамповкой и вытяжкой. Удельная электропроводность лития составляет приблизительно Vs электропроводности серебра и в 11 раз выше электропроводности ртути. [17]
В кристаллическом состоянии кремний хорошо проводит тепло. Его электропроводность составляет 0 007 ( для обычного) — 0 000001 ( для особо чистого) от электропроводности ртути, причем при нагревании она не понижается ( как то характерно для металлов), а повышается. Повышается она и с увеличением давления. Теплота плавления кремния равна 11, теплота атомизации-108 ккал / г-атом. Резко ( в 29 раз) возрастает при плавлении и электропроводность кремния. [18]
В кристаллическом состоянии кремний хорошо проводит тепло. Его электропроводность составляет 0 007 ( для обычного) — 0 000001 ( для особо чистого) от электропроводности ртути, причем при нагревании она не понижается ( как то характерно для металлов), а повышается. Повышается она и с увеличением давления, а при 120 тыс. ат кремний приобретает свойства металла. Теплота плавления кремния равна 11, теплота атомизации-108 ккал / г-атом. Резко ( в 20 раз) возрастает при плавлении и электропроводность кремния. [19]
Яков Ильич стремился развить в своих учениках способность критически относиться к теориям, в том числе и общепринятым, вошедшим в учебники. Хорошо помню его замечания в адрес зонной теории металлов, в том числе и замечание о том, что электропроводность ртути меняется всего на 30 % при переходе из твердого состояния в жидкое, где никаких зон нет. Любую теорию Яков Ильич склонен был считать скорее карикатурой, чем портретом действительности. [20]
Ртуть представляет собой серебристо-белый жидкий металл. Удельная электропроводность ртути при 0 С равна 58 % электропроводности серебра. Электропроводность ртути является стандартной единицей сопротивления — столбик ртути сечением в 1 мм2 и длиной в 106 3 — см. оказывает сопротивление в 1 ом. Молекулы ртути в парах моноатомны. [21]
Ртуть, как и цезий, обладает низкой критической температурой. Изохоры а приведены на рис. 2.12. Для этого плотность была определена экстраполяцией экспериментальных р-р — Т — данных, полученных при более высоких плотностях. На рис. 2.12 видно, что электропроводность ртути при постоянной плотности растет с температурой, если плотность не достигает критической р рс. С увеличением плотности наклон кривых уменьшается, указывая на то, что уменьшается энергетическая щель АЕ. [23]
К тому же электропроводность нового материала близка к электропроводности ртути. Это дало основания говорить о том, что получен полимер с металлическими свойствами. Правда, здесь, видимо, уместно напомнить, что ртуть проводит электрический ток хуже всех металлов. [24]
Еще в конце прошлого столетия изобретательская мысль часто обращалась к различным вариантам электролизеров с вертикальным катодом. В этом случае не возникает опасности оголения стальной основы катода и интенсивного выделения водорода. Однако электролизеры со струйчатыми катодами имеют два существенных недостатка. Один из них связан с относительно небольшой электропроводностью ртути, другой обусловлен тем, что ртутная струя на относительно небольшой высоте разрывается на капли. [25]
Германий имеет серовато-белый, олово — серебристо-белый, а свинец — синевато-белый цвет. Твердость и хрупкость металлов в ряду Ge-Sn-Pb заметно уменьшается: германий тверд и хрупок, свинец царапается ногтем и прокатывается в листы. Олово по пластичности занимает промежуточное положение между германием и свинцом. Электропроводность германия составляет 0 001 электропроводности ртути, у олова она в 8 раз больше, чем у ртути, а у свинца — в 5 раз. Плотность рассматриваемых металлов возрастает от германия к свинцу. Кроме обыкновенного белого олова — [ 3-форма с плотностью 7 3 г / см3, существует серое олово с плотностью 5 75 г / см3, называемое а-формой. [27]
Германий имеет серовато-исльш, олово — ссребристо-белын, а свинец — синевато-белый цвет. Твердость и хрупкость металлов в ряду Ge-Sn-Pb заметно уменьшается: германий тверд и хрупок, свинец царапается ногтем и прокатывается в листы. Олово по пластичности занимает промежуточное положение между германием и свинцом. Электропроводность германия составляет 0 001 электропроводности ртути, у олова она в 8 раз больше, чем у ртути, а у свинца — в 5 раз. Плотность рассматриваемых металлов возрастает от германия к свинцу. Кроме обыкновенного белого олова — 5-форма с плотностью 7 3 г / сы3, существует серое олово с плотностью 5 75 г / см3, называемое а-формой. [29]
Страницы: 1 2
www.ngpedia.ru
Электропроводность — ртуть — Большая Энциклопедия Нефти и Газа, статья, страница 1
Электропроводность — ртуть
Cтраница 1
Электропроводность ртути достаточно мала. [1]
Изотерма электропроводности ртути, представленная на рис. 4.4, дает ясное представление о характере перехода диэлектрик-металл. Область перехода растянута по плотности на порядок. Это указывает на то, что первый этап металлизации связан с наличием в плазме даль-нодействующих сил, проявляющихся еще при умеренных плотностях. [2]
Результаты измерений электропроводности ртути в критической области [7,8] отличаются на два порядка. [3]
Здесь и далее электропроводность ртути принята за единицу. [4]
Здесь и далее условно за единицу электропроводности принята электропроводность ртути. [5]
Электропроводность этих металлов, как правило, близка к электропроводности ртути. Интересным исключением является Yb, электропроводность которого примерно в 3 раза выше, чем других лантанидов. [7]
Электропроводность этих металлов, как правило, близка к электропроводности ртути. Интересным исключением является Yb, электропроводность которого примерно в 3 раза выше, чем других лантанидов. [9]
Электропроводность тория примерно в 5 раз, а урана в 3 раза выше электропроводности ртути. [10]
Двуокись свинца имеет электронную проводимость, таковая составляет для плотной двуокиси величину, близкую к электропроводности ртути и висмута; на двуокиси свинца поэтому возможен процесс разряда и выделения кислорода 4) — главного анодного продукта, образующегося на свинце в сернокислом растворе. Сама защитная пленка двуокиси по мере электро-лиза постепенно осыпается, разрыхляясь выделяющимся кислородом, и это ведет к разрушению свинцового анода. [11]
Благодаря делокализации электронов в слоях графита его электропроводность и теплопроводность велики: значение первой составляет 0 1 электропроводности ртути, а значение второй в 3 раза превышает теплопроводность ртути. Проводимость кристаллов графита вдоль слоев в 100 раз выше, чем в перпендикулярном направлении. [12]
Самым замечательным свойством этих растворов является их высокая электропроводность, достиганЛцая в насыщенном растворе значений такого же порядка, как электропроводность ртути. [13]
Чистые нефтяные продукты, в том числе и масла, обладают ничтожной электропроводностью порядка 10 — 6 — 10 — 18, если принять электропроводность ртути при 0 С равной единице. С повышением температуры электропроводность нефтепродуктов сильно возрастает. [14]
Чрезвычайно много исследований посвящено определению электропроводности ртути в зависимости от температуры. [15]
Страницы: 1 2
www.ngpedia.ru
Электропроводность расплавленных солей — Справочник химика 21
Удельные электропроводности расплавленных солей при температурах, незначительно превышающих температуры [c.451]Электропроводность расплавленных солей, как правило, с температурой увеличивается (исключение составляют соли ртути, индия и некоторые другие). Особенно быстро увеличивается электропроводность при температурах, незначительно превышающих температуры плавления. [c.452]
Электростатическая теория растворов объясняет сравнительно малую электропроводность расплавленных солей огромным тормозящим влиянием ионной атмосферы, которая здесь имеет характер ближнего окружения каждого иона ионами противоположного знака. Растворитель, уменьшающий взаимодействие ионов, отсутствует, а расстояния между нонами очень малы. Вследствие отсутствия сольватации подвижности ионов в расплавах непосредственно связаны с их радиусами, и в ряду щелочных катионов наблюдается правильная последовательность подвижностей [c.452]
Электропроводность расплавленных солей [c.466] Электропроводность расплавленных солей, за исключением некоторых (соли ртути и индия), с температурой увеличивается. Особенно быстро увеличивается электропроводность при температурах, незначительно превышающих температуру плавления. В табл. 14.6 приведены удельные электропроводности некоторых [c.313]
Смещения ионов, возникающие при колебательном двилнарушения структуры расплавов. Можно считать долю свободных , не занимающих равновесного положения ионов степенью диссоциации расплавов и оценить ее на основании электропроводности. В расплавах, как и в водных растворах электролитов, каждый ион окружен ионной атмосферой из ионов противоположного знака. Однако растворитель, уменьшающий взаимодействие ионов, здесь отсутствует, а расстояния между ионами очень малы. Поэтому ионная атмосфера в расплавленных солях имеет характер ближнего окружения каждого иона ионами противоположного знака. Сравнительно малая электропроводность расплавленных солей может быть объяснена с точки зрения современной теории электролитов огромным тормозящим влиянием ионной атмосферы. [c.314]
Электропроводность расплавленных солей с ростом температуры в большинстве случаев также повышается. Наибольший прирост электропроводности наблюдается непосредственно выше температуры плавления, затем он постепенно уменьшается. [c.124]
Электропроводность расплавленных солей непосредственно указывает на их ионную природу. Данные электропроводности в сочетании с числами переноса позволяют оценить свойства ионов, на которые распадается соль, и сделать вывод об ионном строении расплава. [c.125]
УДЕЛЬНЫЕ ЭЛЕКТРОПРОВОДНОСТИ РАСПЛАВЛЕННЫХ СОЛЕЙ [c.127]
Электрический генератор или аккумулятор заставляет электроны направляться к катоду и удаляться от анода. Электроны свободно передвигаются в металлическом или в полуметаллическом проводнике, каким является графит. Однако электроны не могут просто перейти в такое вещество, как соль кристаллическое вещество является изолятором, и электропроводность расплавленной соли не является электронной проводимостью (металлической проводимостью) это проводимость иного рода, называемая ионной или электролитической проводимостью. Она обусловливается движением ионов в жидкости катионы Ка+ движутся к отрицательно заряженному катоду, а анионы С1- передвигаются в направлении положительно заряженного анода (рис. 11.1). [c.305]
Основные научные исследования относятся к неорганической и физической химии. Изучал скорость диффузии ионов в растворах солей и электропроводность расплавленных солей. Усовершенствовал технику фотографической фиксации. Совместно с Г. Бодлендером выдвинул (1899) одну из первых теорий электросродства, в которой понятие об электроне применено к характеристике неорганических соединений и установлена связь между электросродством, с одной стороны, и растворимостью элект- [c.7]
Бильц нашел для температурного коэффициента электропроводности расплавленных солей t следующее элементарное выражение если проводимость х изменяется с повышением температуры от 1 до 2, то [c.144]
С повышением температуры электропроводность расплавленных солей возрастает, как и у других проводников второго рода. Это объясняется увеличением подвижности ионов. Немногочисленные случаи отрицательного температурного коэфициента электропроводности (галоидные соли индия и ртути) объясняются тем, что для этих солей с повышением температуры степень диссоциации убывает быстрее, чем увеличивается подвижность ионов. [c.591]
Изменение электропроводности расплавленных солей с температурой [c.387]
Эти металлы (и многие другие) растворяются также в смеси их собственных галогенидов с галогенидами других металлов. Удельная электропроводность расплавленных солей возрастает при растворении металлов [12], но не в такой степени, как в жидком аммиаке, а поэтому электроны в данном случае не так свободны. Тем не менее дальнейшее исследование восстановительных реакций этих растворов было бы целесообразно, особенно потому, что подобные высокотемпературные системы приобретают возрастающее значение в атомной энергетике. [c.237]
Опыт 126 Электропроводность расплавленной соли [c.90]
Электропроводность расплавленных солей обычно на один-два порядка выше, чем электропроводность водных растворов электролитов, а поэтому возникает необходимость пользоваться специально сконструированными ячейками (см. раздел VI). [c.182]
Изучение расплавленных электролитов вступило в третью стадию своего развития. Приблизительно до 1920 г. этими система.ми интересовались главным образом в связи с их новизной и исследования в большинстве своем были предварительными. В 1926 г. Бильтц и Клемм [18] опубликовали первое систематическое исследование, в котором были сопоставлены значения электропроводности расплавленных солей в зависимости от того, какое положе- [c.204]
Электропроводность расплавленных солей играет большую роль в электрометаллургии, ряд процессов которой основан на электролизе, например получение алюминия из раствора глинозема в криолите, натрия — из хлорида натрия, магния — из хлорида магния и т. д. [c.152]
Электропроводность расплавленных солей играет большую роль в электрометаллургии, ряд процессов которой основан на электро- [c.181]
Для ТОГО чтобы получить представление об электропроводности расплавленных солей, мы приведем несколько значений удельных и эквивалентных электропроводностей (в обратных омах) при определенных температурах для вычисления последних значений должны быть известны плотности солей при температуре опыта. [c.142]
Б. Ф. Марков и Ю. К- Делимарский [21] предложили отношение количества свободных (неупорядоченных) ионов к общему чис-слу ионов в расплаве считать степенью электролитической диссоциации расплавленной соли. Такая величина имеет определенный физический смысл и, как показали эти авторы, может быть оценена при помощи электропроводности расплавленных солей. [c.35]
Вязкость расплавленных солей обусловливается различной подвижностью ионов [8]. В то время как электропроводность расплавленной соли определяется наиболее подвижными (как правило, положительными) ионами, вязкость ее, наоборот, — наименее подвижными (как правило, отрицательными) ионами. Действительно, поскольку в вязком течении расплавленной соли участвуют ионы обоих знаков, скорость этого течения, заключающаяся в переходе отдельных ионов из исходных положений равновесия в соседние (преимущественно в направлении течения жидкости), и должна лимитироваться более медленными ионами. [c.97]
ЭЛЕКТРОПРОВОДНОСТЬ и ПЕРЕНОС ИОНОВ В РАСПЛАВЛЕННЫХ СОЛЯХ 13. Зависимость электропроводности расплавленных солей от их структурных особенностей и температуры [c.104]
Количественным выражением электропроводности расплавленных солей так же как и водных растворов, является удельная, а также молярная или эквивалентная электропроводность. Под удельной электропроводностью понимают величину, обратную электрическому сопротивлению вещества (расплавленной соли) в объеме куба, имеющего площадь основания 1 см и высоту I см. Удельная электропроводность обозначается обычно через % и имеет размерность ом -см , а удельное сопротивление через р, причем размерность его ом см (табл. 24). Если же между двумя бесконечно большими параллельными пластинками (электродами), находящимися на расстоянии 1 см одна от другой, поместить один грамм-моль или один грамм-эквивалент вещества (расплавленной соли), то величина электропроводности такого слоя вещества и даст соответственно молярную или эквивалентную электропроводность. Молярную электропроводность обычно обозначают символом ц, а эквивалентную символом Размерность обоих этих величин ом см . [c.104]
Весьма важным обстоятельством, которое приходится принимать во внимание при исследовании электропроводности расплавленных солей, является связь между электропроводностью и вязкостью расплавленных солей. Это вытекает из того положения, что прохождению тока через расплав противодействует вязкость среды. Поэтому сильно вязкие расплавы обладают и малой электропроводностью. [c.110]
Электропроводность расплавленных солей намного выше проводимости водных растворов (табл. XIV- ) и, например, для смеси КС1 + Т1С1з при 800°С достигает 1—5 Ом- -см , п то время как электропроводность водного раствора хлорида калия не превышает 0,3 Ом -см . [c.467]
Для работы требуется Прибор для определения электропроводности (см. рис. 49). — Прибор для определения электропроводности расплавленных солей (см. рис. 50). — Прибор для наблюдения за передвижением ионов (см. рис. 51). — Прибор для криоскопии (рис. 48). — Штатив с пробирками. — Цилиндр мерный емк. 10 мл. — Пипетки емк. 1 мл и 10 мл. — Ацетат натрия кристаллический.— Нитрат калия кристаллический. — Уксусная кислота безводная. — Хлорид аммония кристаллический. — Хлорид калия перекристаллизовакный (готовые навески). — Хлорид натрия технический. — Иодид калия, 0,5 н. раствор. — Спирт, 5%-ный раствор. — Сахар, 5%-ный раствор. — Соляная кислота, 10%-ный раствор. — Нитрат калия, 5%-ный раствор. — Едкий натр, 5%-ный раствор.—Аммиак, 25%-ный и 1%-ный растворы. — Раствор фенолфталеина. — Раствор метилового оранжевого. — Раствор лакмуса. — Раствор крахмала. — Вода дистиллированная. — Вода дистиллированная прокипяченная.— Снег или лед. — Навески хлорида калия около 0,050 г следует брать на аналитических весах с точностью до 0,001 г. [c.120]
К расплавленным электролитам относят расплавы солей и оксидов. В расплавах при температурах, близких к температурам плавления, имеются в относительно свободном состоянии те же ионы, которые характерны для соли в кристаллическом состоянии. Так, в расплаве Na l имеются ионы Na+ и СЬ, в расплаве криолита есть ионы Na+ и AlFe . Каждый ион в расплаве занимает место (в среднем по времени), отвечающее минимальной потенциальной энергии относительно потенциальной энергии соседних ионов. Такое положение ионов аналогично положению их в кристаллической решетке при равновесии. Поскольку каждый ион колеблется около положения равновесия, его потенциальная энергия при отклонении от равновесного состояния увеличивается. Такие смещения ионов вызывают нарушения структуры расплава, подобные дефектам кристаллической решетки. Нарушений в расплаве много больше, чем в кристалле, J1 эти нарушения предопределяют относительно высокую электропроводность расплавленных солей. [c.313]
Расплавленные электролиты широко применяют в электрометаллургии и технической электрохимии их используют также в ядерной технике и топливных элементах. Высокая электропроводность расплавленных солей послужила причиной тому, что такие электролиты называют ионными жидкостями. Ионные жидкости делятся на расплавы солей и их смесей и на расплавы окислов и их смесей. Последние представляют собой смеси окислов неметаллов (5102, Р2О5 и т. п.) с окислами металлов (Ь120, Маг0,М 0 и др.) и описываются формулой Ме,,Оц—Л/ рО,, где Ме — металл, Ы — неметалл. [c.88]
Электропроводность расплавленных солей. Расплавленные соли обладают каждая сама по себе более или менее значительной электропроводностью, зависящей от темпера1урь и от степени чистоты соли. [c.386]
Это значит, что увеличение электропроводности расплава с повы шением температуры несколько отстает от уменьшения его аязкостн. Вязкость и электропроводность расплавленных солей также подчиняются указанной закономерности. [c.146]
Изучение электропроводности расплавленных солей имеет большое значение для познания природы этих солей и строения их расплавов. Не менее важно и прикладное значение электропроводности расплавленных электролитов. Действительно, в электролизерах при заданной плотности тока и температуре междуполюсное расстояние будет определяться величиной электропроводности электролита. Чем выше электропроводность, тем больше может быть междуполюсное расстояние в электролизере и тем выше выход по току. С другой сторот1ы, при прочих равных условиях более высокая проводимость электролита позволяет увеличивать плотность тока и тем самым повысить производительность электролизера. [c.104]
Изменение электропроводности расплавленных солей в зависимости от температуры характеризуется температурньш коэффициентом, причем различают абсолютный и относительный температурный коэффициент электропроводности. [c.109]
chem21.info
Температура плавления хлоридов ртути — Справочник химика 21
Электропроводность расплавленной ионной соли обычно на один-два порядка превышает электропроводность водного раствора того же электролита. Так, например, удельная электропроводность расплава КС1 при 800°С равна 24,2 См/м, тогда как удельная электропроводность водного раствора хлорида калия Проводимость расплавов остается, однако, на 3—4 порядка ниже проводимости жидких металлов, например ртути. Для сравнения электропроводности различных расплавленных солей, как и водных растворов, используют эквивалентную электропроводность. Однако при рассмотрении расплавов возникает проблема, связанная с сильной зависимостью Л от температуры и с необходимостью выбора соответствующей температуры сравнения, тем более что температуры плавления разных веществ существенно отличны. Особенно резкое изменение электропроводности происходит вблизи температуры плавления, так как при плавлении разрушается (диссоциирует) ионная решетка. Обычно сравнивают величины Л при абсолютных температурах, превышающих на 10% абсолютную температуру плавления. При этом, по-видимому, наступает практически полная диссоциация кристаллической решетки. [c.90]С водородом бром образует бромистый водород НВг, бесцветный газ, растворяющийся в воде с образованием сильной бромистоводородной кислоты. Соединения брома с одно- двухвалентными металлами представляют собой типичные соли. Большинство бромидов, за исключением бромидов серебра, меди, ртути и свинца, хорошо растворимы в воде. Многие из бромидов образуют один или несколько кристаллогидратов. Растворимость бромидов в воде, как правило, выше растворимости соответствующих хлоридов, но ниже растворимости иодидов. Бромиды растворяются в органических растворителях значительно легче, чем соответствующие хлориды. Например, бромистый натрий растворим в спирте, в то время как хлористый натрий нерастворим. Бромиды имеют температуру плавления и кипения несколько ниже, чем соответствующие хлориды. Многие бромиды образуют с соответствующими хлоридами непрерывный ряд твердых растворов. [c.89]
Аналогичные результаты получаются и с хлоридами кадмия, ртути, а также йодидами всех металлов подгруппы цинка, если температура синтеза на 10—20 °С превышает температуры плавления исходных соединений. В отношении более низких температур синтеза, а также применения других исходных веществ экспериментальные данные отсутствуют. [c.239]
По внешнему виду хлорид ртути (И) представляет собой мелкокристаллическое вещество белого цвета. Температура плавления 278°, температура кипения 307°, удельный вес 5,4. Кипение хлорида ртути (П) происходит без разложения, что позволяет очищать его путем возгонки. При возгонке препарат кристаллизуется в бесцветных призматических кристаллах ромбической формы. [c.216]
Все характеристические галогениды Zn, d, Hg — бесцветные кристаллические вещества. Температуры плавления фторида, хлорида и бромида кадмия намного выше соответствующих производных цинка и ртути. Кроме того, dFa кристаллизуется в структуре aFa. Все эти факты говорят о большей ионности обсуждаемых производных кадмия. [c.135]
Представляется невероятным, чтобы в различных циклах как четного, так и нечетного ряда превращений инверсии конфигурации хлорвинильной группы происходили бы именно столько раз, сколько необходимо, чтобы вновь получилась та конфигурация, которая была в исходном соединении. Следует отметить, что Несмеянов и сотрудники выделили и охарактеризовали различные промежуточные продукты, устанавливая при этом геометрическую конфигурацию как на основании температуры плавления, так и другими методами, например на основании спектра комбинационного рассеяния б с-(транс-р-хлорвинил) ртути, а также превращением бис-(транс- -хлорвинил)оловоди-хлорида в г ис-изомер действием ультрафиолетового света. Об установлении структуры гранс-С1СН = СНН С1 с помощью дифракции рентгеновских лучей упоминалось ранее. [c.129]
Хлорид висмута, оксихлорид висмута и хлоровисмутаты. Хлорид висмута Bi lg был получен еще Бойлемг [при нагревании висмута с хлоридом ртути(П)]. Для его приготовления лучше всего растворить окись висмута в соляной кислоте или металлический висмут в царской водке и после упаривания перегнать остаток без доступа воздуха. Хлорид висмута представляет собой белоснежную кристаллическую, на влажном воздухе расплывающуюся массу (удельный вес 4,6 температура плавления 232° температура кипения 447°). [c.730]
В полную противоположность фториду другие галогениды Hg2+ ведут себя как соединения ковалентного характера. Хлорид двухвалентной ртути при кристаллизации образует молекулярную решетку. По сравнению с HgF2 все другие галогениды имеют очень низкие температуры плавления и кипения, например Hg l2 плавится при 280 °С. Они также обладают заметной растворимостью во многих органических растворителях. В водных растворах они существуют почти исключительно ( 99%) в виде молекул HgX2, но в некоторой степени протекает гидролиз, который можно описать следующим уравнением [c.410]
Мгновенный обмен с толуолдитиолом [24]. Меркаптиды ртути (3— 5 мг) вводят в стеклянную капиллярную трубку для определения температуры плавления и добавляют одинаковое по весу количество подогретого (жидкого) толуол-3,4-дитиола. Трубку центрифугируют для получения суспензии меркаптидов в толуол-3,4-дитиоле. Открытый конец трубки соединяют с отверстием дозатора хроматографа и нижнюю часть трубки нагревают в масляной бане за 15 сек до 245—260°. Происходит реакция обмена, и выделившиеся меркаптаны уносятся потоком газа-носителя в колонку, где и разделяются. Дальнейшие подробности, касающиеся метода мгновенного обмена, описаны в разделах В и Д. Реакция протекает медленно, и меркаптаны, имеющие более 4 атомов углерода, недостаточно летучи, чтобы образовать отчетливые пики. Комплексы органических сульфидов хлорида и ртути дают свободный сульфид наряду с небольшими количествами соответствующего тиола. [c.281]
В настоящей статье мы описываем восстановление борофторида три-п-нитрофенилоксония до соответствующего аминопроизводного и некоторые свойства последнего. Восстановление проводилось в обычных условиях оловом и соляной кислотой. Полученный в этой реакции хлорид три-и-аминотрифенилоксония переведен реакциями двойного обмена в другие соли этого катиона — иодид, двойную соль иодида с йодной ртутью и хлороплатинат. Все эти соли не имеют четкой температуры плавления, а при нагревании постепенно обугливаются, не плавясь, при 150—200° С. [c.320]
Реакции несимметричных ртутноорганических соединений с четыреххлористым углеродом в присутствии перекиси бензоила в качестве инициатора проведены следующим путем. Навеска (5—10 г) ртутноорганического соединения, RHgR, н 0,4—0,8 г перекиси бензоила в 80—120 жл сухого четыреххлористого углерода загружены в ампулу, которая запаяна при охлаждении и помещена в предварительно нагретую до 90° С водяную баню, затем нагрета на кипящей бане в течение 8 час. После охлаждения ампула вскрыта, образовавшийся кристаллический осадок вместе со следами металлической ртути отделен. Перекристаллизацией из спирта или ацетона в большинстве случаев получался сразу чистый ртутноорганический хлорид, свободный от следов металлической ртути. Из фильтрата отогнан четыреххлористый углерод, остаток обработан 20%-HI.IM раствором щелочи на кипящей водяной бане в течение 2 час. Остаток четыреххлористого углерода отделен от водного щелочного раствора, подкисленного соляной кислотой. При этом выпадала кристаллическая карбоновая кислота, образовавшаяся из R I3. Она выделялась обычным путем. Остаток четыреххлористого углерода отогнан под водоструйным насосом. На стенках колбы остались кристаллы гексахлорэтана. После возгонки они имели температуру плавления (и температуру плавления смешанной пробы) 185° С (в запаянном капилляре). Растворитель, собранный при перегонке в ловушке, охлажденной до —20° С, пронитрован. Выделен 2,4-дипитрохлорбензол с температурой плавления (и температурой плавления смешанной пробы) 51° С. [c.765]
Для элементов всех групп периодической системы характерно заметное различие между фторидами и другими галогенидами. В отличие от фторида солеобразные свойства хлорида бериллия выражены слабо он дымит в атмосфере влажного воздуха, не проводит электрический ток в расплавленном состоянии и легко возгоняется. Он характеризуется линейной структурой С1—Ве—С1. Хлорид, бромид и иодид магния имеют слоистую решетку [45] и еще в большей степени отличаются от фторида тем, что обладают значительно более низкой температурой плавления (т. пл. МдР2= 1400°, тогда как температура плавления других галогенидов магния приблизительно 700°), а также тем, что легче растворяются в воде. Хлорид кальция, имеющий отношение ионных радиусов 0,55 (фторид 0,79), имеет слегка деформированную решетку рутила иодид имеет слоистую решетку [66]. Известны также различия в растворимости и легкоплавкости фторидов, с одной стороны, и других галогенидов стронция и бария, с другой. Данные относительно структуры этих солей в настоящее время далеки от полноты. Большинство хлоридов, бромидов и иодидов цинка, кадмия и ртути кристаллизуются в виде слоистых решеток различных типов. Исключение составляет только хлорид двухвалентной ртути, образующий молекулярную решетку, в которой линейные молекулы Hg l2 связаны друг с другом только относительно слабыми ван-дерваальсовскими силами [66]. [c.19]
chem21.info
Электропривод типа Б — Электропроводность паров ртути в закритическом состоянии
а | б | в | г | д | е | ж | з | и | й | к | л | м | н | о | п | р | с | т | у | ф | х | ц | ч | ш | щ | ы | ь | э | ю | я|< << >> > |
Электропривод типа Б
Электропривод транспортера с деталями из пластмасс
Электропривод червячного типа
Электропривод червячного типа
Электропривод ЭПВ запорной арматуры технологических трубопроводов
Электропривод-лебедка пальцевого затвора с лотком,
Электроприводной плунжерный насос
Электроприводной плунжерный электропривод 2— регулятор 3-муфта 4 —редуктор
Электроприводной поршневой насос
Электроприводы насосов вертикального типа
Электроприводы непрерывного агрегата горячего цинкования
Электроприводы основных механизмов УНРС
Электропроводки в стальных коробах.
Электропроводки с прокладкой проводов по подкладным стальным полосам и проволоке. а — общий вид проводки
Электропроводности
Электропроводности бинарных солей.
Электропроводность
Электропроводность -плазмы при давлении, Па
Электропроводность .
Электропроводность 1 -ного раствора сульфоната, содержащего 24 аммиака при различных температурах.
Электропроводность 1 -ных растворов сульфоната, содержащих хлорид натрия при различных температурах.
Электропроводность 1 -ных растворов сульфонола НП-1, содержа-ш их аммиак, при различных температурах.
Электропроводность в двойных системах
Электропроводность в двойных системах
Электропроводность в зависимости от концентрации сульфаминовокислых солей кобальта, никеля, железа
Электропроводность в с
Электропроводность в систе-
Электропроводность в системе NaF — A1F, — Н,0
Электропроводность в системе вода — хлорная кислота при 50 С
Электропроводность в системе трехбромистый мышьяк — этиловый эфир
Электропроводность взвеси минеральной части 5г1-лей Сибири в среде азота, соответствующая их зольности.
Электропроводность водных растворов азотной кислоты .
Электропроводность водных растворов азотной кислоты.
Электропроводность водных растворов фтороборных кислот при 25 С
Электропроводность водных растворов фтороборных кислот при 25 С
Электропроводность воздуха при разных давлениях Ро 10 Н м
Электропроводность железа и платины в зависимости от температуры
Электропроводность и температурный коэффициент электросопротивления в системе серебро—магиий
Электропроводность и тер-.мостойкость графитовой ткани при высоких температурах.
Электропроводность и термо-э.д.с. твердых растворов РЬТе 5пТе, приготовленных из образцов ЗпТе и РЬТе с одинаковым типом проводимости
Электропроводность ионизированных паров воды при больших давлениях
Электропроводность ионного кристалла как функция 1 Г .
Электропроводность катионита КУ-2 — экспериментальные точки О — расчетные точки
Электропроводность кварцевого стекла в зависимости от температуры.
Электропроводность кислот в ледяной уксусной кислоте
Электропроводность КОН в зависимости от концентрации раствора и температуры.
Электропроводность кристаллов бромистого калия, содержащих F-центры .
Электропроводность М, УОз
Электропроводность мембраны в растворах Ba Ia—Na l
Электропроводность паров ртути в закритическом состоянии
|< << >> > |
chem21.info
Ртуть теплопроводность — Справочник химика 21
Простые вещества по свойствам составляющих их элементов делятся на металлы и неметаллы. Металлы имеют ряд общих свойств. Это — металлический блеск, высокая теплопроводность и электропроводность. Бее металлы, кроме ртути, при нормальных условиях (температура 0°С, давление 1 атм.) являются твердыми веществами, прочными и пластичными. Металлы обладают более высокими восстановительными свойствами, чем неметаллы. Подробнее о металлах и неметаллах разговор пойдет в главе 2 и в главе 7, В приведенной на форзаце Периодической системе элементов разными цветами выделены типичные металлы и неметаллы. [c.10]Металлы — хорошие проводники тепла и электричества. При прохождении электрического тока через металлические проводники не происходит переноса частиц металла (электронная проводимость, или проводимость первого рода). По способности проводить тепло и электричество металлы располагаются приблизительно в одном и том же порядке лучшие проводники —серебро и медь, затем золото, алюминий, железо и худшие —свинец и ртуть. Следовательно, между теплопроводностью металлов и их электропроводностью наблюдается почти постоянное соотношение. [c.297]
Существенные сведения относительно природы химической связи в металлах можно получить на основании двух характерных особенностей по сравнению с ковалентными и ионными соединениями. Металлы, во-первых, отличаются от других веществ высокой электропроводностью и теплопроводностью, во-вторых, в обычных условиях являются кристаллическими веществами (за исключением ртути), структуры которых характеризуются высокими координационными числами. [c.104]
Слабые металлические связи сообщают графиту его металлические свойства электропроводность, в некоторых чистых образцах в два раза превышающую электропроводность ртути, теплопроводность, почти равную теплопроводности меди, и т. п. [c.287]
Теплопроводность. Теплопроводность воды относительно велика по сравнению с теплопроводностью других жидкостей (кроме ртути). В этом отношении к ней близки глицерин и некоторые соляные растворы. Относительно большая теплопроводность воды является важным фактором для теплоотдачи, так как коэффициент теплоотдачи прямо пропорционален теплопроводности. [c.290]
По теплопроводности твердые тела делят на три группы. Первая группа — металлы с теплопро- гоо водностью от 6,8 ккал (м-ч-град) для ртути или 40 ккал (м-ч-град) для стали до 394 ккал] (м-ч-град) для серебра. Однако эти величины в сильной степени зависят от примесей и загрязнений материала. Вторую группу составляют строительные материалы с теплопроводностью от 0,2—0,25 ккал (м-ч- град) для обыкновенного строительного кирпича до 16 ккал (м ч — град) для карборундового кирпича. Третья группа представляет собой теплоизоляционные материалы с теплопроводностью от 0,033 ккал [c.279]
Нагревание ртутью и жидкими металлами. Для нагрева до температур 400—800 С и выше в качестве высокотемпературных теплоносителей могут быть эффективно использованы ртуть, а также натрий, калий, свинец и другие легкоплавкие металлы и их сплавы. Эти теплоносители отличаются больщой плотностью, термической стойкостью, хорошей теплопроводностью и высокими коэффициентами теплоотдачи. Однако жидкие металлы и их сплавы характеризуются очень малыми значениями критерия Прандтля (Рг =s 0,07). В связи с этим коэффициенты теплоотдачи от жидких металлов следует рассчитывать по специальным формулам . [c.320]
Металлы отличаются характерным металлическим блеском, ковкостью, тягучестью, могут прокатываться в листы или вытягиваться в проволоку, обладают хорошей теплопроводностью и электрической проводимостью. При комнатной температуре все металлы (кроме ртути) находятся в твердом состоянии. [c.29]
По физическим свойствам все металлы — твердые вещества (кроме ртути, которая при обычных условиях жидкая), они отличаются от неметаллов особым видом связи (металлическая связь). Валентные электроны слабо связаны с конкретным атомом и внутри каждого металла существует так называемый электронный газ. Поэтому все металлы обладают высокой электропроводностью (т. е. они — проводники в отличие от неметаллов-диэлектриков), особенно медь, серебро, золото, ртуть и алюминий высока и теплопроводность металлов. Отличительным свойством многих металлов является их пластичность (ковкость), вследствие чего они могут быть прокатаны в тонкие листы (фольгу) и вытянуты в проволоку (олово, алюминий и др.), однако встречаются и достаточно хрупкие металлы (цинк, сурьма, висмут). [c.157]
Графит хорошо проводит тепло (в 3 раза лучше ртути) и обладает близкой к металлам электропроводностью (0,1 от электропроводности ртути). И электро- и теплопроводность больше параллельно слоям, чем перпендикулярно им. Максимум теплопроводности графита наблюдается около 0°С, а электропроводности — около 600 °С. Механическая прочность графита при переходе от обычных температур к 2500 °С возрастает почти вдвое. Его сжимаемость примерно в 20 раз больше сжимаемости алмаза. Заметное окисление графита при нагревании на воздухе наступает лишь выше 700 С. [c.502]
Обычно установки термической регенерации работают периодически. Используется как огневой обогрев через стены реторты, так и электрический с помощью наружных или внутренних нагревательных элементов сопротивления или нагревателей индукционного типа. Производительность установок термической регенерации ртути обычно лимитируется низкой теплопроводностью шламов после отгонки из них влаги. Вследствие этого прогрев всей массы шлама в реторте до температуры не ниже 600 °С происходит медленно и вся операция отгонки в реторте емкостью около 0,5 т обычно занимает 24—36 ч. [c.273]
В приборе Свентославского (рис. V. 54, а) раствор, подлежащий исследованию, наливают в нижний резервуар 1 прибора через боковой отросток сосуда так, чтобы жидкость находилась в узкой трубке 2. При кипении пар вместе с капельками жидкости устремляется по трубке 2 в отверстие сосуда 3, расположенное вблизи нижней части внутренней запаянной трубки 4, которая содержит ртуть или силиконовое масло (последние увеличивают теплопроводность системы). Сюда же погружают шарик термометра. Нагреватель представляет собою жестяное полукольцо, покрытое асбестом, на который намотаны электроспираль. Это полукольцо охватывает нижнюю трубку 5 в месте соединения ее с резервуаром 1. В ходе опыта нагревание регулируют так, чтобы нижняя часть трубки с термометром [c.330]
Связи между атомами углерода одной и той же плоскости в решетке графита имеют типичный ковалентный характер. Отдельные плоскости связаны друг с другом в основном межмолекулярными силами, но отчасти между ними действуют и металлические связи (примерно один свободный электрон на 18 тыс. атомов углерода). Наличием последних обусловлена высокая электропроводность графита (0,1 от электропроводности ртути) и его хорошая теплопроводность (в три раза больше, чем у ртути). [c.300]
Для решеток с металлической структурой характерно наличие в узлах кроме атомов также и ионов, которые образуются за счет отрыва электронов. Атомы и ионы находятся в состоянии непрерывного обмена электронами, причем процесс этот происходит без затраты или освобождения энергии (в единицу времени число атомов, потерявших электроны, и присоединивших их ионов равно). В процессе такого непрерывного обмена электронами часть их стационарно остается в свободном состоянии, образуя так называемый электронный газ . Наличие свободно перемещающихся электронов и динамически обменивающихся ими нонов и атомов сообщает металлическим кристаллам специфические свойства пластичность, электронную проводимость, высокую теплопроводность, металлический блеск, непрозрачность. Специфика структуры металлических кристаллов создает условия для большого разнообразия их свойств. Так, например, температура затвердевания ртути —38,9° С, в то время как вольфрам плавится лишь при 3380° С натрий мягок, как воск, а рений с трудом можно обработать инструментом, изготовленным из специальных сортов стали. [c.321]
Пример 4-1. При измерении переменной температуры термометром важно знать, насколько быстро термометр реагирует на изменение температуры. Полупериодом называют интервал времени, в пределах которого начальная разность между истинной температурой и показанием термометра сокращается наполовину после внезапного изменения истинной температуры. Необходимо определить этот полупериод для ртутного термометра, находящегося в потоке воздуха. Пусть ртутный шарик имеет форму цилиндра радиусом 3 мм. Коэффициент теплопроводности ртути к = 7,А5 ккал/м-ч-град (см. приложение). Коэффициент температуропроводности а = 0,0166 л /ч, термическим сопротивлением тонкой стеклянной стенки пренебрегаем. Коэффициент теплообмена для потока воздуха а = 50 ккал/м -ч-град. [c.106]
Вторая операция называется закалкой. Образец после выдержки при заданной температуре резко охлаждается. Это достигается сбрасыванием образца из печи в холодную инертную жидкость с хорошей теплопроводностью (например, в воду, ртуть). При резком охлаждении происходит фиксация того состояния, в котором образец находился при температуре выдержки, т. е. кристаллические фазы, если они есть, фиксируются ( замораживаются ) в таком виде и количестве, в каком они находились при температуре выдержки, а жидкая фаза застывает в стеклообразном состоянии. [c.284]
Медь обладает высокой электро- и теплопроводностью, коррозионной стойкостью и отлично переносит горячую и холодную обработку давлением. Она устойчива к атмосферной коррозии. Чистая пресная >ода почти не действует на медь. Скорость коррозии меди в морской воде 0,05 мм/год. В растворах неокислительных солей она стойка. Примеси олова и ртути увеличивают скорость коррозии меди. [c.23]
Для большого количества жидкостей составляющая коэффициента затухания обусловленная теплопроводностью, много меньше составляющей а , вызванной вязкостью жидкости. В некоторых жидкостях, например, ртути, наоборот, величина в несколько раз больше [c.79]
К металлам относят вещества, которые обладают рядом характерных свойств хорошей электро- и теплопроводностью и отражательной способностью к световому излучению (блеск и непрозрачность), отрицательным температурным коэффициентом электропроводности, повышенной пластичностью (ковкость). Данные свойства металлов обусловлены наличием подвижных электронов, которые постоянно перемещаются от одного атома к другому. Вследствие такого обмена в металлической структуре всегда имеется некоторое количество свободных электронов, т. е. не принадлежащих в данный момент каким-либо определенным атомам. Чрезвычайно малые размеры электронов позволяют им свободно перемещаться по всему металлическому кристаллу и придавать металлам характерные свойства. Слабой связью валентных электронов с ядром атома объясняются и многие свойства металлов, проявляющиеся при химических реакциях образование положительно заряженных ионов-катионов, образование основных окислов и др. Металлы с хорошей электропроводностью одновременно обладают высокой теплопроводностью (рис. 105). Наибольшей электропроводностью обладают металлы серебро, медь, золото, алюминий. Медь и алюминий широко используются для изготовления электрических проводов. По твердости металлы располагаются в ряд, приведенный на рис. 106. По плотности все металлы условно делят на две группы легкие, плотность которых не более 5 г см , и тяжелые. Плотность, температуры плавления и кипения некоторых металлов указаны в табл. 18. Наиболее тугоплавким металлом является осмий, наиболее легкоплавким — ртуть. [c.266]
Для выяснения зависимости значений коэффициента / от температуры Одноатомных газов Зайцевой, [Л.2-26] было проведено экспериментальное исследование теплопроводности шести одноатомных газов. Ею экспериментально была определена теплопроводность гелия, неона, аргона, криптона, сенона и паров ртути при давлениях от 50 до 500 мм рт. ст. и температурах от О до 500° С. Установка Зайцевой исключала необходимость больших поправок к экспериментальным значениям в отличие от данных Каннулика и Кармана [Л. 2-27], уже при 300 С вводивших по правки до 20% к экспериментальным значениям. Обработка экспериментальных данных теплопроводности Зайцевой показала, что зависимость теплопроводности указанных шести одноатомных газов от температуры описывается уравнением [c.134]
Это означает, что условия протекания процесса внутри рассматриваемой системы зависят не только от входных, но и от выходных потоков. Чтобы лучше это представить, предположим, что рассматриваются потоки ртути в этом случае вследствие условий теплопроводности в ртутной колонне диффузионный член увеличится и может стать очень большим. Если ртуть, после того как выйдет из системы, снова попадет в теплый поток, это вызовет в колонне поток тепла в обратном направлении. [c.192]
Об автоматическом регулировании остаточного давления в областях среднего и высокого вакуума в литературе имеется сравнительно мало сведений. При использовании вакуумметров, основанных на принципе измерения теплопроводности газа, Лапорт [49] рекомендует подключить к мостовой схеме Пирани сигнальное устройство, которое дает звуковой сигнал при увеличении давления выше заданного предела. Нисбет [54 ] описал прибор, позволяющий поддерживать в сосуде, продуваемом воздухом, постоянное давление 10″ мм рт. ст. Мельпольдер [55] описал регулятор давления, обеспечивающий в интервале от 10″ до 10″ мм рт. ст. точность регулирования, равную 10″ мм рт. ст. Схема данного регулятора приведена на рис. 384. Принцип его работы заключается во введении в манометр Мак-Леода четырех впаянных контактов 9—12. С помощью устройства 13 в манометре Мак-Леода каждую минуту поднимают уровень ртути. Регулирование давления осуществляется с помощью контактов 9 и При уменьшешш-давления в системе ниже заданного контакт 10 замыкается, при этом он через реле 5 и 2 закрывает электромагнитный клапан 5. Этот клапан размещен на штуцере 4, соединяющем систему с ваку-умным насосом. Вакуумированный аппарат подсоединяют к шту- [c.451]
В большинстве случаев при обычных условиях в такой же последовательности, как и электрическая проводимость, изменяется теплопроводность металлов. Последняя обусловливается высокой подвижностью свободных электронов и колебательным движением атомов, благодаря чему происходит быстрое выравии-вание температуры в массе металла. Наибольшая теплопроводность у серебра и меди, наименьшая — у висмута и ртути. [c.152]
Рассматриваемый прибор был создан Л. П. Филипповым для измерения теплопроводности электролитов, в том числе и электропроводящих, относительным методом цилиндрического слоя [Л. 1-48]. Схематическое изображение этого прибора дано на рис. 1-12. Исследуемая жидкость заполняет цилиндрический слой 1 между внешней 2 и внутренней 3 стеклянными трубками. Во внутренней трубке диаметром около 2 мм и длиной 8 см помещен нагревательный элемент 8 из константановой проволоки диаметром 0,1 мм, намотанной бифилярно на фарфоровую соломку толщиной 1 мм. В конце трубки 3 имеется спай медно-константановой термопары, провода которой выводятся сквозь каналы в фарфоровой соломке. Весь прибор погружен в ртуть 5, термостатируемую потоком жидкости в стеклянной рубашке б. В ртути находится второй спай 7, вместе со спаем 4 образующий дифференциальную термопару, [c.67]
Пленочное К. возникает на несмачиваемых пов-стях нагрева (напр., К. ртути в стеклянной трубке) на смачиваемых пов-стях пузырьковое К. переходит в пленочное (первый кризис К.) при достижении первой критич. плотности теплового потока 9,р.1. Интенсивность теплоотдачи при пленочном К. значительно меньше, чем при пузьфьковом, что обусловлено малыми значениями коэф. теплопроводности ).[Вт/(м К)] и плотности пара по сравнению с их значениями для жидкости. При ламинарном движении пара в пленке а при турбулентном движении интенсивность [c.385]
Способ I [1—3]. Необходимое для получения препарата олово вводяг в реакцию в виде реакционноспособной амальгамы. Последнюю готовят путем слабого нагревания 6,5 частей ртути в фарфоровой чашке на песчаной бане (работать под тягой ), постепенно прибавляя к ней оловянные стружки (14 частей). По окончании реакции смеси дают охладиться. Амальгаму разбивают стеклянной палочкой в момент затвердевания на сравнительно крупные зерна, которые затем подвергают дальнейшему измельчению. Полученный препарат хорошо перемешивают с 8 ч. порошкообразной серы и 6,8 ч. тонкоизмельченного хлорида аммония и переносят в керамический тигель, неплотно закрытый глиняной или фарфоровой крышкой. Реакционную массу умеренно нагревают (до 400°С) под сильной тягой или лучше на воздухе (ртуть ) на песчаной бане в течение длительного времени, пока не прекратится выделение паров. Затем температуру быстро повышают до начала красного каления. Как только закончится выделение паров серы нли бурая реакционная масса в отдельных местах начнет приобретать черный цвет, на-грер.ание прекращают и медленно охлаждают содержимое тигля без сильного притока воздуха. В зависимости от количества исходных компонентов реакция продолжается 3—4 ч. После охлаждения тигель осторожно разбивают и отделяют поверхностный слой, состоящий из хорошо образованных с золотистым блеском кристаллов. Под ними также находится SnSa, однако в виде хуже образованных кристаллов. На дне часто остается небольшое количество чистой серы. При слишком большой загрузке иногда происходит разложение (почернение) продукта на дне и на стенках тигля вследствие перегрева, обусловленного плохой теплопроводностью реакционной массы. При этом внутри тигля компоненты часто даже не успевают прореагировать полностью. Часть продукта, представляющую собой хорошо образованные кристаллы, очищают путем возгонки на песчаной бане, причем SnSa получается в виде великолепных прозрачных чешуек с золотистым блеском. Выход около 50%. [c.830]
Металлы имеют плотноупакованную кристаллическую структуру и характеризуются металлическим типом связи электроны, осуществляющие эту связь, принадлежат не двум отдельным атомам, а свободно перемещаются по всему кристаллу. Металлы характеризуются высокой электрической проводимостью и теплопроводностью. При нормальных усповиях ртуть находится в жидком состоянии, остальные металлы — твердые вещества обладают сравнительно низкими значениями энергии ионизации и сродства к электрону. [c.192]
Вскоре после этого вопрос с большей тщательностью был изучен М. Кпудсепом [30]. Исследуемым веществом была ртуть, которая особенно пригодна по ряду причин. Давление пара ртути хорошо известно в широкой области, так что можно выбрать такие температуры опыта, при которых длина свободного пробега атомов ртути была столь велика, что при данном расстоянии поверхности жидкости от сильно охлаждаемой стенки на последней удерживались все испаренные атомы и обратного их возвращения не происходило. К тому же при достаточно медленном испарении хорошая теплопроводность ртути гарантировала правильное определение температуры поверхности. [c.33]
Пример XVIII. 1. Вычислить теплопроводность ртути (М = 200,6) при 293 К, зная р = 13 500 кг/м Ср — 138,2 Дж/(кг-К) г = 0,95-10- 0м м. [c.342]
chem21.info