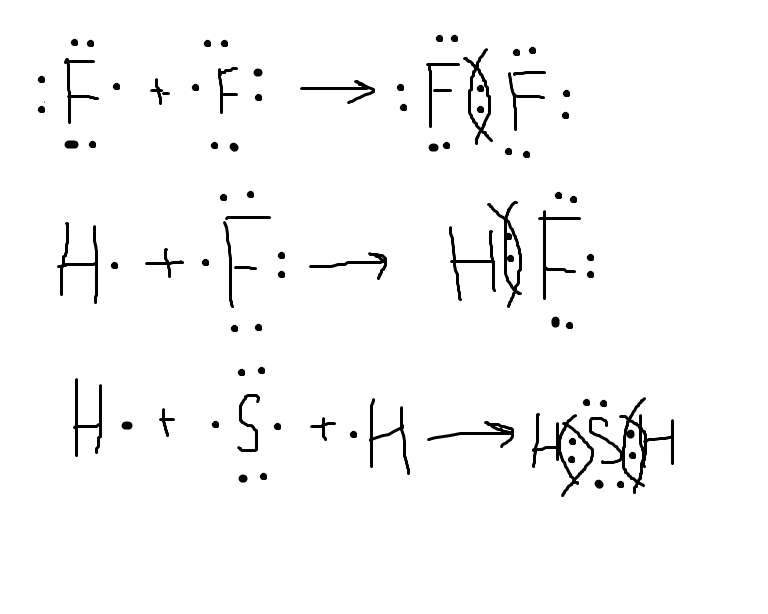Сульфид бария — Википедия (с комментариями)
Ты — не раб!
Закрытый образовательный курс для детей элиты: «Истинное обустройство мира».
http://noslave.org
Материал из Википедии — свободной энциклопедии
Сульфи́д ба́рия (се́рнистый ба́рий) — бариевая соль сероводородной кислоты. Химическая формула — BaS.
Физические свойства
Сульфид бария образует бесцветные кристаллы кубической сингонии, пространственная группа F m3m, параметры ячейки a = 0,63877 нм, Z = 4, структура типа хлорида натрия NaCl [1][2].
Соединение плавится при температуре 2200°C.
Хорошо растворяется в воде, практически нерастворим в спирте. Из раствора кристаллизуется в виде гексагидрата BaS·6H2O.
Получение
- В промышленности: прокаливание сульфата бария с углем или коксом (промежуточный продукт при получении бария):
- <math>\mathsf{BaSO_4 + 4 \ C \longrightarrow \ BaS + 4 \ CO \uparrow}</math>
- <math>\mathsf{Ba(OH)_2 + \ H_2S \longrightarrow \ BaS + 2 \ H_2O}</math>
Химические свойства
- <math>\mathsf{BaS + 2 \ HCl \longrightarrow \ BaCl_2 + \ H_2S \uparrow}</math>
- Гидролизуется водой до гидросульфида:
- <math>\mathsf{2 \ BaS + 2 \ H_2O \longrightarrow \ Ba(HS)_2 + \ Ba(OH)_2}</math>
- <math>\mathsf{2 \ BaS + 2 \ H_2O + O_2 \longrightarrow 2 \ Ba(OH)_2 + 2 \ S \downarrow}</math>
- <math>\mathsf{BaS + 2 \ O_2 \longrightarrow \ BaSO_4}</math>
Применение
- Промежуточный продукт при получении бария и его соединений.
- Для удаления волосяного покрова со шкур в кожевенной промышленности.
Токсичность
Сульфид бария является ядовитым веществом как вследствие токсичности сероводорода, образующегося в результате его гидролиза, так и из-за ионов бария. Следует различать сульфид и сульфат бария, используемый в медицине как рентгеноконтрастный препарат. Случайная замена этих веществ может привести к летальному исходу.
Напишите отзыв о статье «Сульфид бария»
Примечания
- ↑ Диаграммы состояния двойных металлических систем / Под ред. Н. П. Лякишева. — М.: Машиностроение, 1996. — Т. 1. — 992 с. — ISBN 5-217-02688-X.
- ↑ B. Predel Ba-S (Barium-Sulfur) // Landolt-Börnstein — Group IV Physical Chemistry. — 1992. — Т. 5b. — С. 1-2. — DOI:10.1007/10040476_445.
Отрывок, характеризующий Сульфид бария
– Иди с богом своей дорогой. Я знаю, твоя дорога – это дорога чести. – Он помолчал. – Я жалел о тебе в Букареште: мне послать надо было. – И, переменив разговор, Кутузов начал говорить о турецкой войне и заключенном мире. – Да, немало упрекали меня, – сказал Кутузов, – и за войну и за мир… а все пришло вовремя. Tout vient a point a celui qui sait attendre. [Все приходит вовремя для того, кто умеет ждать.] A и там советчиков не меньше было, чем здесь… – продолжал он, возвращаясь к советчикам, которые, видимо, занимали его. – Ох, советчики, советчики! – сказал он. Если бы всех слушать, мы бы там, в Турции, и мира не заключили, да и войны бы не кончили. Всё поскорее, а скорое на долгое выходит. Если бы Каменский не умер, он бы пропал. Он с тридцатью тысячами штурмовал крепости. Взять крепость не трудно, трудно кампанию выиграть. А для этого не нужно штурмовать и атаковать, а нужно терпение и время. Каменский на Рущук солдат послал, а я их одних (терпение и время) посылал и взял больше крепостей, чем Каменский, и лошадиное мясо турок есть заставил. – Он покачал головой. – И французы тоже будут! Верь моему слову, – воодушевляясь, проговорил Кутузов, ударяя себя в грудь, – будут у меня лошадиное мясо есть! – И опять глаза его залоснились слезами.– До лжно будет, если все этого захотят, нечего делать… А ведь, голубчик: нет сильнее тех двух воинов, терпение и время; те всё сделают, да советчики n’entendent pas de cette oreille, voila le mal. [этим ухом не слышат, – вот что плохо.] Одни хотят, другие не хотят. Что ж делать? – спросил он, видимо, ожидая ответа. – Да, что ты велишь делать? – повторил он, и глаза его блестели глубоким, умным выражением. – Я тебе скажу, что делать, – проговорил он, так как князь Андрей все таки не отвечал. – Я тебе скажу, что делать и что я делаю. Dans le doute, mon cher, – он помолчал, – abstiens toi, [В сомнении, мой милый, воздерживайся.] – выговорил он с расстановкой.
– Ну, прощай, дружок; помни, что я всей душой несу с тобой твою потерю и что я тебе не светлейший, не князь и не главнокомандующий, а я тебе отец. Ежели что нужно, прямо ко мне. Прощай, голубчик. – Он опять обнял и поцеловал его. И еще князь Андрей не успел выйти в дверь, как Кутузов успокоительно вздохнул и взялся опять за неконченный роман мадам Жанлис «Les chevaliers du Cygne».
wiki-org.ru
Сульфид бария — это… Что такое Сульфид бария?
Сульфид бария (сернистый барий) — бариевая соль сероводородной кислоты. Химическая формула — BaS.
Физические свойства
BaS представляет собой бесцветные кубические кристаллы хорошо растворимые в воде, практически нерастворимые в спирте. Из раствора кристаллизуется в виде гексагидрата BaS•6H
Получение
- В промышленности: прокаливание сульфата бария с углем или коксом (промежуточный продукт при получении бария):
Химические свойства
1. Легко разлагается кислотами с выделением сероводорода:
2. Гидролизуется водой до гидросульфида:
3. Водные растворы BaS медленно окисляются кислородом воздуха с выделением серы:
4. При прокаливании на воздухе образуется сульфат бария:
Применение
- Промежуточный продукт при получении бария и его соединений.
- Для удаления волосяного покрова со шкур в кожевенной промышленности.
Токсичность
Сульфид бария является ядовитым веществом как вследствие токсичности сероводорода, образующегося в результате его гидролиза, так и из-за ионов бария. Следует различать сульфид и сульфат бария, используемый в медицине как рентгеноконтрастный препарат. Случайная замена этих веществ может привести к летальному исходу.
Примечания
dic.academic.ru
| Химическая формула | Название соединения | Номер по классификатору CAS |
|---|---|---|
| BAs | арсенид бора | 12005-69-5 |
| BAsO4 | арсенат бора | |
| BBr3 | бромид бора | 10294-33-4 |
| BCl3 | хлорид бора | 10294-34-5 |
| BF3 | трифторид бора | 7637-07-2 |
| BI3 | иодид бора | 13517-10-7 |
| BN | нитрид бора | 10043-11-5 |
| B3 | борная кислота | 10043-35-3 |
| BP | фосфид бора | 20205-91-8 |
| BPO4 | ортофосфат бора | 13308-51-5 |
| B2Cl4 | хлорид бора | 13701-67-2 |
| B2F4 | фторид бора | 13965-73-6 |
| B2H6 | диборан | 19287-45-7 |
| B2O3 | оксид бора | 1303-86-2 |
| B2S3 | сульфид бора | 12007-33-9 |
| B3N3H6 | боразол | 6569-51-3 |
| B4C | карбид бора | 12069-32-8 |
| Ba2 | алюминат бария | 12004-04-5 |
| Ba2 | арсенит бария | 125687-68-5 |
| Ba2 | арсенат бария | 56997-31-0 |
| BaB6 | гексаборид бария | 12046-08-1 |
| Ba2·H2O | моногидрат бромата бария | 10326-26-8 |
| Ba2·2H 2O | дигидрат бромата бария | |
| BaBr2 | бромид бария | 10553-31-8 |
| Ba2 | формиат бария | 541-43-5 |
| Ba2 | цианид бария | 524-62-1 |
| Ba2 | ацетат бария | 543-80-6 |
| BaC2O4 | оксалат бария | 516-02-9 |
| BaC4 | карбид бария | 50813-65-5 |
| BaCO3 | карбонат бария витерит | 513-77-9 |
| Ba2 | перхлорат бария | 13465-95-7 |
| BaCl2 | хлорид бария | 10361-37-2 |
| BaCrO4 | хромат бария | 10294-40-3 |
| BaF2 | фторид бария | 7787-32-8 |
| BaFeSi4O10 | гиллеспит | |
| BaHgI4 | тетраиодомеркурат бария | 10048-99-4 |
| BaI2 | иодид бария | 13718-50-8 |
| BaK22 | хромат бария-калия | 27133-66-0 |
| BaMnO4 | манганат бария | 7787-35-1 |
| Ba2 | перманганат бария | 7787-36-2 |
| BaMoO4 | молибдат бария | 7787-37-3 |
| BaN6 | азид бария | 18810-58-7 |
| Ba2 | нитрит бария | 13465-94-6 |
| Ba2 | нитрат бария | 10022-31-8 |
| Ba2 | ниобат бария | 12009-14-2 |
| BaNb2O6 | метаниобат бария | 12009-14-2 |
| BaO | оксид бария | 1304-28-5 |
| Ba2 | гидроксид бария baryta | 17194-00-2 |
| BaO2 | пероксид бария | 1304-29-6 |
| Ba2 | метафосфат бария | 13466-20-1 |
| BaS | сульфид бария | 21109-95-5 |
| Ba2 | тиоцианат бария | 2092-17-3 |
| BaS2O3 | тиосульфат бария | 35112-53-9 |
| BaSiF6 | гексафторосиликат бария | 17125-80-3 |
| BaSO3 | сульфит бария | 7787-39-5 |
| BaSO4 | сульфат бария барит | 7787-43-7 |
| BaSe | селенид бария | 1304-39-8 |
| BaSeO3 | селенит бария | 13718-59-7 |
| BaSeO4 | селенат бария | 7787-41-9 |
| BaSiO3 | метасиликат бария | 13255-26-0 |
| BaSi2 | силицид бария | 1304-40-1 |
| BaSi2O5 | дисиликат бария | 12650-28-1 |
| BaSn3 | станнат бария | 12009-18-6 |
| BaTeO3 | теллурит бария | 58440-17-8 |
| BaTeO4·3H2O | тригидрат теллурата бария | 28557-54-2 |
| BaTiO3 | титанат бария | 12047-27-7 |
| BaU2O7 | оксид урана-бария | 10380-31-1 |
| BaWO4 | вольфрамат бария | 7787-42-0 |
| BaZrO3 | цирконат бария | 12009-21-1 |
| Ba2Na5 | ниобат дибария-натрия | 12323-03-4 |
| Ba2P2O7 | пирофосфат бария | 13466-21-2 |
| Ba2V2O7 | пированадат бария | |
| Ba2XeO6 | перксенат бария | |
| Ba32 | хромат бария | 12345-14-1 |
| Ba3N2 | нитрид бария | 12047-79-9 |
| Ba32 | ортофосфат бария | |
| Ba32 | ортованадат бария | 39416-30-3 |
| BeB2 | борид бериллия | 12228-40-9 |
| Be2 | боргидрид бериллия | 17440-85-6 |
| BeBr2 | бромид бериллия | 7787-46-4 |
| Be2 | формиат бериллия | 1111-71-3 |
| Be2 | ацетат бериллия | 543-81-7 |
| Be2 | ацетилацетонат бериллия | 10210-64-7 |
| BeCl2 | хлорид бериллия | 7787-47-5 |
| BeF2 | фторид бериллия | 7787-49-7 |
| BeI2 | иодид бериллия | 7787-53-3 |
| BeO | оксид берилллия бромеллит | 1304-56-9 |
| Be2 | гидроксид бериллия | 13327-32-7 |
| BeS | сульфид бериллия | 13598-22-6 |
| BeSO4 | сульфат бериллия | 13510-49-1 |
| Be2C | карбид бериллия | 506-66-1 |
| Be3N2 | нитрид бериллия | 1304-54-7 |
| BiBO3 | борат висмута | |
| BiBr3 | бромид висмута | 7787-58-8 |
| Bi3 | ацетат висмута | 22306-37-2 |
| BiC6H5O7 | цитрат висмута | 813-93-4 |
| BiCl3 | хлорид висмута | 7787-60-2 |
| BiF3 | фторид висмута | 7787-61-3 |
| BiI3 | иодид висмута | 7787-64-6 |
| Bi3·5H2O | пентагидрат нитрата висмута | 10035-06-0 |
| BiOCl | оксохлорид висмута | 7787-59-9 |
| BiOI | оксоиодид висмута | 7787-63-5 |
| 2CO3 | карбонат висмутила | 5892-10-4 |
| BiPO4 | ортофосфат висмута | 10049-01-1 |
| Bi5 | метаванадат висмута | |
| Bi2Se3 | селенид висмута | 12068-69-8 |
| Bi23 | молибдат висмута | 13565-96-3 |
| Bi2O3 | оксид висмута | 1304-76-3 |
| Bi2S3 | сульфид висмута | 1345-07-9 |
| Bi2Se3 | селенид висмута | 12068-69-8 |
| Bi2Te3 | теллурид висмута теллуровисмутит | 1304-82-1 |
| Bi23 | ортовольфрамат висмута | |
| BrCl | хлорид брома | 13863-41-7 |
| BrO3 | бромат | 15541-45-4 |
| Br2 | бром | 7726-95-6 |
4108.ru
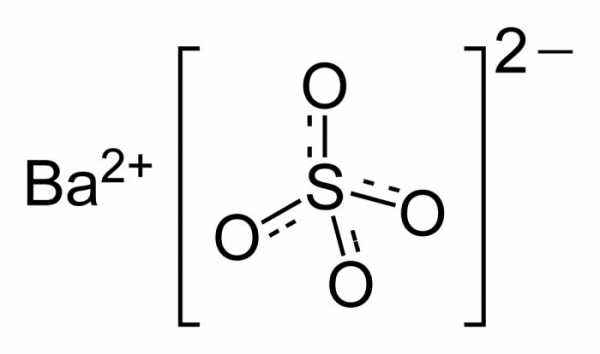
Сульфат бария — это… Что такое Сульфат бария?
Сульфа́т ба́рия (сернокислый барий) — сернокислая соль бария. Химическая формула — BaSO4.
Получение
- Взаимодействием солей, оксида, пероксида или гидроксида бария с серной кислотой или растворимыми сульфатами:
- BaCl2 + H2SO4 → BaSO4↓ + 2HCl
- Ba(NO3)2 + Na2SO4 → BaSO4↓ + 2NaNO3
- BaO + H2SO4 → BaSO4↓ + H2O
- В промышленности большие объёмы сульфата бария получают из природного минерала тяжелого шпата, при этом исходное сырьё измельчается и отмучивается.
Свойства
Кристаллическое вещество — белый порошок или прозрачный кристалл, практически нерастворим в воде (растворимость 0,0015 г/л при 18 °C) и других растворителях. В природе встречается в виде минерала барита, который является основной бариевой рудой.
Химические свойства
Сульфат бария не растворим в щелочах и большинстве кислот, однако растворим в хлорной воде, бромистоводородной и йодистоводородной кислотах, растворах гидрокарбонатов щелочных металлов[1]. Вступает во взаимодействие с концентрированной серной кислотой, которая переводит нерастворимый сульфат в хорошо растворимый гидросульфат бария:
- BaSO4 + H2SO4 → Ba(HSO4)2
При прокаливании с углём или коксом сульфат восстанавливается до сульфида:
- BaSO4 + 2C → BaS + 2CO2
При температуре свыше 1600 °C разлагается:
- 2BaSO4 → 2BaO + 2SO2 + O2
Токсичность
Сульфат бария не является токсичным для организма веществом, в отличие от всех растворимых солей бария, и именно поэтому возможно его применение в качестве рентгеноконтрастного вещества.
Применение
Аналитическая химия
В аналитической химии сульфат бария применяют как хорошую гравиметрическую форму для определения сульфат-ионов и ионов бария в гравиметрическом анализе.
Рентгеноконтрастное вещество
Часто используется при рентгеновских исследованиях желудочно-кишечного тракта как радиоконтрастное вещество, так как тяжёлые атомы бария хорошо поглощают рентгеновское излучение. Хотя все растворимые соли бария ядовиты, сульфат бария практически нерастворим в воде (и в растворе соляной кислоты, которая содержится в желудочном соке), поэтому он нетоксичен. Для рентгенографического исследования органов пищеварения пациент принимает внутрь суспензию сульфата бария («бариевую кашу») с содержанием бария 58,7 %.
Пигмент-наполнитель
Сульфат бария является одной из составляющих часть смесей, используемых в качестве белых пигментов:
- Смесь сульфата бария с сульфидом цинка, получаемая взаимодействием растворов сульфида бария и сульфата цинка — литопон.
- Мелкокристаллический сульфат бария, получаемый взаимодействием осаждением сульфата натрия из раствора сульфида бария — бланфикс (фр. Blanc fixe).
Употребляется как клеевая краска, так как не растворим в органических растворителях. Эти белила дешевле свинцовых, в отличие от них не токсичны и не темнеют от сернистого водорода.
Пиротехника
Сульфат бария используется как цветовой компонент для пиротехнических средств, так как ионы бария способствуют окрашиванию пламени в зеленый цвет. В настоящее время для этих целей в основном используют нитрат бария, за счет того, что он является сильным окислителем и способствует энергичному горению пиротехнической смеси.
Другие применения
Сульфат бария используется для различных промышленных целей:
- В качестве наполнителя для фото- и писчей бумаги, для линолеума и для некоторых лако-красочных материалов. См., например, баритаж.
- Как белый наполнитель для пластмасс, а также как компонент буровых растворов для увеличения их плотности.
- В фотометрии: для окраски фотометрических шаров
- В электрохимической промышленности при изготовлении свинцовых аккумуляторов как расширитель активной массы отрицательного электрода.
- При производстве пасты для травления стекла.
- При производстве некоторых огнеупорных материалов.
- Протектор для рентгеновского излучения (бариевая штукатурка рентгеновских кабинетов).
- Добавление в продукцию Lego на случай, если ребенок проглотит деталь.
- Как основной компонент циммерита — обмазки брони немецких танков и САУ периода Второй мировой войны.
Ссылки
Литература
- Учебник общей химии Некрасов Б. В. 1981 год, в 2 томах.
Примечания
- ↑ Н.С. Фрумина, Н.Н. Горюнова, С.Н. Еременко. Аналитическая химия бария. — Москва: Наука, 1977.
dic.academic.ru
Что такое бария сульфат? Как получают сульфат бария? :: SYL.ru
Бария сульфат – это неорганическое вещество с химической формулой BaSO4. Представляет собой белый порошок без запаха, нерастворимый в воде. Его белизна и непрозрачность, а также высокая плотность определяют основные области применения.
История названия
Барий относится к щёлочноземельным металлам. Последние названы так потому, что, по словам Д. И. Менделеева, их соединения образуют нерастворимую массу земли, а окислы «имеют землистый вид». Барий в природе содержится в виде минерала барита, который представляет собой бария сульфат с различными примесями.
Впервые он был обнаружен шведскими химиками Шееле и Ганом в 1774 году в составе так называемого тяжелого шпата. Отсюда возникло и название минерала (от греч. «барис» – тяжелый), а затем и самого металла, когда в 1808 г. его выделил в чистом виде Гемфри Деви.
Физические свойства
Поскольку BaSO4 – это соль серной кислоты, то ее физические свойства отчасти определяются самим металлом, который является мягким, химически активным и серебристо-белым. Природный барит бесцветен (иногда белый) и прозрачен. Химически чистый BaSO4имеет цвет от белого до бледно-желтого, он негорючий, с температурой плавления 1580°С.

Какая масса сульфата бария? Молярная масса его равна 233,43 г/моль. Он обладает необычайно высоким удельным весом – от 4,25 до 4,50 г/см3. Учитывая нерастворимость в воде, высокая плотность делает его незаменимым в качестве наполнителя водных буровых растворов.
Химические свойства
BaSO4 – это одно из самых труднорастворимых в воде соединений. Его можно получить из двух хорошо растворимых солей. Возьмем водный раствор натрия сульфата – Na2SO4. Его молекула в воде диссоциирует на три иона: два Na+ и один SO4 2-.
Na2SO4 → 2Na+ + SO4 2-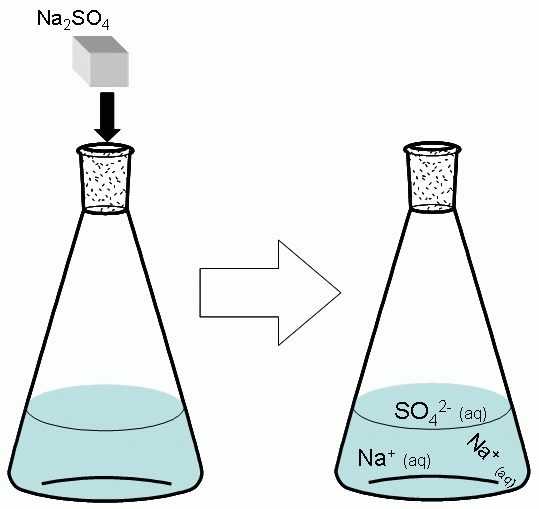
Возьмем также водный раствор хлорида бария – BaCl2, молекула которого диссоциирует на три иона: один Ba2+ и два Cl—.
BaCl2 → Ba2+ + 2Cl—
Смешаем водный раствор сульфата и смесь, содержащую хлорид. Бария сульфат образуется в результате соединения в одну молекулу двух ионов с одинаковым по величине и противоположным по знаку зарядом.
Ba2+ + SO4 2-→ BaSO4
Ниже вы можете увидеть полное уравнение этой реакции (так называемое молекулярное).
Na2SO4+ BaCl2→ 2NaCl + BaSO4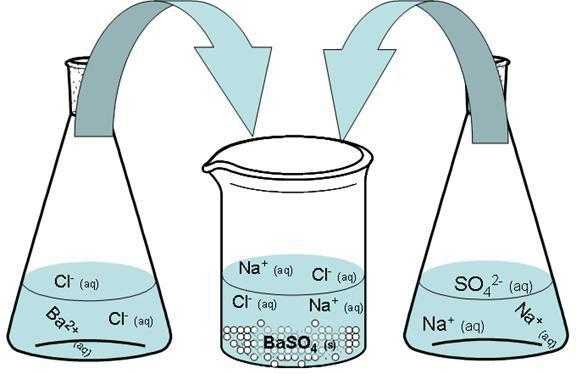
В результате образуется нерастворимый осадок сульфата бария.
Товарный барит
На практике исходным сырьем для получения товарного сульфата бария, предназначенного для использования в буровых растворах при бурении нефтегазовых скважин, является, как правило, минеральный барит.
Термин «первичный» барит относится к товарной продукции, которая включает в себя сырой материал (получаемый из шахт и карьеров), а также продукты простого обогащения такими методами, как промывка, осаждение, сепарация в тяжелых средах, флотация. Большая часть сырого барита требует доведения его до минимальной чистоты и плотности. Минерал, который используется в качестве наполнителя, измельчают и просеивают до однородного размера так, чтобы, по меньшей мере, 97 % его частиц имели размер до 75 мкм, и не более 30 % были менее 6 мкм. Первичный барит также должен быть достаточно плотным, чтобы его удельный вес составил 4,2 г/см3 или выше, но при этом достаточно мягким, чтобы не повредить подшипники.
Получение химически чистого продукта
Минеральный барит зачастую загрязнен различными примесями, в основном оксидами железа, окрашивающими его в различные цвета. Он обрабатывается карботермическим способом (нагревом с коксом). В результате получается сульфид бария.
BaSO4 + 4 С → BaS + 4 СО
Последний, в отличие от сульфата, растворим в воде и легко реагирует с кислородом, галогенами и кислотами.
BaS + Н2SO4 → BaSO4 + Н2S
Чтобы получить высокочистый выходной продукт, используется серная кислота. Сульфат бария, образуемый по такому процессу, часто называют бланфиксом, что в переводе с французского означает «белый фиксированный». Он часто встречается в потребительских продуктах, таких как краски.

В лабораторных условиях сульфат бария образуется путем объединения в растворе ионов бария и сульфат-ионов (см. выше). Поскольку сульфат является наименее токсичной солью бария из-за ее нерастворимости, отходы, содержащие другие его соли, иногда обрабатывают сульфатом натрия, чтобы связать весь барий, являющийся достаточно токсичным.
Из сульфата в гидроксид и обратно
Исторически барит использовался для производства гидроксида бария Ba(OH)2, необходимого при рафинировании сахара. Это вообще очень интересное и широко используемое в промышленности соединение. Оно хорошо растворимо в воде, образует раствор, известный как баритовая вода. Ее удобно использовать для связывания сульфат-ионов в различных составах путем образования нерастворимого BaSO4.
Выше мы видели, что при нагреве в присутствии кокса из сульфата легко получить водорастворимый сульфид бария – BaS. Последний же при взаимодействии с горячей водой образует гидроксид.
BaS + 2H2O → Ba(OH)2 + H2S↑
Гидроксид бария и сульфат натрия, взятые в растворах, при смешивании дадут нерастворимый осадок сульфата бария и едкий натрий.
Ba(OH)2 + Na2SO4 = BaSO4 + 2NaOH

Получается, что природный бария сульфат (барит) промышленным способом сначала превращается в бария гидроксид, а затем служит для получения того же сульфата при очистке различных солевых систем от сульфат-ионов. Точно так же будет проходить реакция и при очистке от ионов SO4 2- раствора сернокислой меди. Если сделать смесь «гидроксид бария + сульфат меди», то в результате получится гидроксид меди и нерастворимый бариевый сульфат.
CuSO4 + Ba(OH)2 → Cu(OH)2 + BaSO4↓
Даже в реакции с самой серной кислотой ее сульфат-ионы будут полностью связаны барием.
Использование в буровых растворах
Около 80 % мирового производства сульфата бария, очищенного и измельченного барита, потребляется в качестве компонента буровых растворов при создании нефтегазовых скважин. Добавка его увеличивает плотность жидкости, закачиваемой в скважину, с целью лучшего сопротивления высокому пластовому давлению и предотвращения прорывов.
Когда скважина бурится, долото проходит через различные образования, каждое из которых имеет свои характеристики. Чем больше глубина, тем больший процент барита должен присутствовать в структуре раствора. Дополнительным преимуществом является то, что бария сульфат – немагнитное вещество, поэтому он не мешает проведению различных измерений в скважине с помощью электронных устройств.
Лакокрасочная и бумажная промышленность
Большая часть синтетического BaSO4 используется в качестве компонента белого пигмента для красок. Так, бланфикс в смеси с двуокисью титана (TiO2) продается в качестве белой масляной краски, применяемой в живописи.
Сочетание BaSO4 и ZnS (сульфид цинка) дает неорганический пигмент, который называется литопоном. Он используется в качестве покрытия для определенных сортов фотобумаги.
Совсем недавно бария сульфат был применен для осветления бумаги, предназначенной для струйных принтеров.
Применение в химической промышленности и цветной металлургии
В производстве полипропилена и полистирола BaSO4используют в качестве наполнителя в пропорции до 70 %. Он имеет эффект увеличения стойкости пластмасс к кислотам и щелочам, а также придает им непрозрачность.
Он также используется для производства других соединений бария, в частности его карбоната, который применяется для изготовления светодиодного стекла для телевизионных и компьютерных экранов (исторически в электронно-лучевых трубках).
Формы, используемые в отливке металлов, часто покрывают бария сульфатом для предотвращения сцепления с расплавленным металлом. Так поступают при изготовлении анодных медных пластин. Их отливают в медные изложницы, покрытые слоем сульфата бария. Когда жидкая медь затвердевает в виде готовой анодной пластины, она может быть легко извлечена из литейной формы.
Пиротехнические устройства
Поскольку соединения бария испускают зеленый свет при горении, то соли этого вещества часто используются пиротехнических формулах. Хотя нитрат и хлорат являются более распространенными, чем сульфат, последний широко используется в качестве компонента пиротехнических стробоскопов.
Рентгеноконтрастный препарат
Бария сульфат является рентгеноконтрастным агентом, используемым для диагностики определенных медицинских проблем. Так как подобные вещества являются непрозрачными для рентгеновских лучей (блокируют их в результате своей высокой плотности), то области тела, в которых они локализуются, появляются как белые участки на рентгеновской пленке. Это создает необходимое различие между одним (диагностируемым) органом и другими (окружающими его) тканями. Контраст поможет врачу увидеть любые особые условия, которые могут существовать в этом органе или части тела.
Бария сульфат принимается через рот или ректально при помощи клизмы. В первом случае он делает пищевод, желудок или тонкий кишечник непрозрачным для рентгеновских лучей. Таким образом, они могут быть сфотографированы. Если вещество введено при помощи клизмы, то толстую кишку или кишечник можно увидеть и зафиксировать рентгеновскими лучами.
Доза сульфата бария будет разной для разных пациентов, все зависит от типа теста. Препарат выпускается в виде специальной медицинской бариевой суспензии или в таблетках. Различные тесты, при которых нужен контраст и рентгеновское оборудование, требуют различного количества суспензии (в некоторых случаях необходим прием препарата в форме таблетки). Контрастное вещество должно использоваться только под непосредственным контролем врача.
www.syl.ru
Химическая связь
1. Ковалентная неполярная связь образуется за счет общих электронных пар в простых веществах — неметаллах (H2, O2, Cl2, N2)
2. Ковалентная полярная связь образуется в сложных веществах между атомами неметаллов (HCl, H2O, NH3)
3. Ионная связь возникает в сложных веществах между разноименно заряженными ионами металлов и неметаллов (NaCl, CaO)
4. Металлическая связь образуется в простых веществах металлах за счет свободных электронов и положительных ионов (Al, Fe, Cu)
Давайте порассуждаем вместе
1. Вещество с ковалентной неполярной связью имеет формулу:
1) HF
2) F2
3) NaF
4) Ca
Ответ: простым веществом-неметаллом является фтор F2, значит в молекуле фтора связь ковалентная неполярная.
2. Вещество с ковалентной полярной связью имеет формулу:
1) PF5
2) S8
3) KCl
4) Mg
Ответ: сложным веществом, состоящим из атомов неметаллов является фторид фосфора (V), значит в этом веществе ковалентная полярная связь
3. Вещество с ионной связью имеет формулу:
1) H2S
2) P4
3) Ag
4) BaF2
Ответ: сложным веществом, состоящим из ионов металла бария и неметалла фтора, является фторид бария, значит в этом веществе ионная связь.
4. Веществом с металлической связью является:
1) аммиак
2) цинк
3) хлорид магния
4) озон
Ответ: Цинк является простым веществом — металлом, значит связь в цинке металлическая
5. Гидроксид натрия образован
1) металлической и ковалентной связями
2) только ионной связью
3) ионной и ковалентной связями
4) только ковалентной связью
Ответ: Связь между ионом натрия и гидроксид-ионом ионная, а между атомом кислорода и атомом водорода ковалентная полярная
6. Ковалентная полярная связь присутствует в веществе
1) железо
2) серная кислота
3) кислород
4) бромид калия
Ответ: ковалентная полярная связь присутствует в серной кислоте, так как это вещество сложное и образовано атомами водорода, кислорода и серы (неметаллами)
7. Химическая связь соответственно: ионная, ковалентная полярная, металлическая, ковалентная неполярная
Решение задач по химии — любой сложности. Готовые и на заказ.
1) NaCl, SO2, Ca, H2
2) HCl, Al, Cl2, CuCl2
3) K, CO2, FeBr3, O2
4) F2, Zn, H2O, BaS
Ответ: хлорид натрия — вещество с ионной связью, оксид серы (IV) — вещество с ковалентной связью, кальций — простое вещество — металл, связь металлическая, в молекуле водорода — связь ковалентная неполярная
dx-dy.ru