Гидроксид алюминия — это… Что такое Гидроксид алюминия?
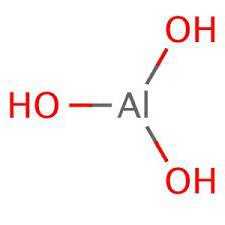
Гидроксид алюминияГидрокси́д алюми́ния, вещество с формулой (а также , и ) — соединение оксида алюминия с водой. Белое студенистое вещество, плохо растворимое в воде, обладает амфотерными свойствами.
Получают при взаимодействии солей алюминия с водными растворами щёлочи, избегая их избытка:
Свежеосаждённый гидроксид алюминия способен взаимодействовать с:
Высушенный гидроксид алюминия представляет собой белое кристаллическое вещество, нерастворимое в кислотах и щёлочах.
Отдельные случаи взаимодействия гидрооксида алюминия с: гидрооксидом рубидия
Al(OH)3 + 3RbOH (водн. р-р) — Rb3[Al(OH)6]
оксидом рубидия
2Al(OH)3 + Rb2O (сплав.) — 2RbAlO2 + 3H2O
гидроксидом цезия
Al(OH)3 + CsOH (сплав.) — CsAlO2 + 2H2O
карбонатом цезия
2Al(OH)3 + Cs2CO3 (сплав.) — 2CsAlO2 + 3H2O + CO2
Называется орто- и метааллюминевая кислота.
Применение
Используется при очистке воды, так как обладает способностью поглощать (адсорбировать) различные вещества, в медицине, в качестве антацидного средства,[1] в качестве адъюванта при изготовлении вакцин.[2] Применяется в качестве антипирена (подавителя горения) в пластиках и других материалах.
Примечания
dic.academic.ru
Ответы@Mail.Ru: Помогите мне,пожалуйста,решить задания!
1) 4P+5O2=2P2O5 Окислитель O: O +2e —> O— Восстановитель P: P-5e —> P+++++ соединение, окисслительно-восстановительная, необратимая, некаталитическая, экзотермическая P2O5+3h3O=2h4PO4 соединение, не окислительно восстановительная, необратимая, некаталитическая, экзотермическая h4PO4+3KOH=3K3PO4+3h30 3H+ + PO4— +3K+ + 3OH- =3K+ + PO4— +3h30 H+ + OH- = h30 h4PO4 — ортофосфорная кислота KOH — гидроксид калия K3PO4 — ортофосфат калия h3O — вода обмен, не окислительно-восстановительная (нейтрализация) , необратимая, некаталитическая 2) NaOH > Mg(OH)2 > Al(OH)3 C ростом электроотрицательности металла, которая наблюдается в группе слева направо уменьшается полярность связи O-Me, как следствие, она становится менее разрываемой и реже можеет происходить отщепление гдроксогруппы, которая в растворе обеспечивает основные свойства Al(OH)3+3HNO3=Al(NO3)3+3h30 Al(OH)3 + 3H+ + 3NO3- = Al+++ +3NO3- + 3h3O Al(OH)3 + 3H+ = Al+++ +3h3O (строго говоря, гидроксид алюминия имеет амфотерные cв-ва, т. е может вести себя и как кислота, и как основание. Если неоюходимо продемонстрировать его кислотные cв-ва, то подойдет такая реакция: NaOH+Al(OH)3=Na[Al(OH)4] Na+ + OH- +Al(OH)3 =Na+ + [Al(OH)4]- OH- +Al(OH)3 =[Al(OH)4]- ) 3)Se. Селен. VIА группа 4-го периода. Высший оксид — SeO3 — триоксид селена обладает ярко выраженными кислотнами свойствами (селеновая кислота h3SeO4 сильнее серной) 4)m(Cu(SO)4=16 гр m (Fe)=12 гр m (Cu) -? Запишем уравнение реакции CuSO4 + Fe = FeSO4 + Cu Найдем кол-во в-ва сульфата меди. Для этого сначала найдем его молярную массу, а потом разделим на нее его массу M(CuSO4)=64+32+4*16=160 г/моль n(CuSO4)=m(CuSO4)/M(CuSO4)=16/160= 0,1 моль Аналогично для железа M(Fe)=56 г/моль n(Fe)=m(Fe)/M(Fe)=12/56= 0,214 моль Мы видим, что реагенты взяты в пропорции 1:2,14, а по стехиометрическому соотношению необходимо 1:1. Таким образом, CuSO4 — в недостатке, железо в избытке, расчеты ведем по недостатку Из уравнения реакции видно, что из 1-го моля сульфата меди выделяется 1 моль меди. Таким образом, мы можем найти кол-во в-ва меди n(Cu)=n(CuSO4)=0,1 моль Теперь мы можем найти ее массу. Молярная масса меди M(Cu)=64 г/моль m=n*M=0,1*64=6,4 г Ответ 6,4 *** Это, вообще, по объему нормальная контрольная для какого-нибудь 9-го класса. Не стыдно всю работу на других перекладывать?
touch.otvet.mail.ru
Ответы@Mail.Ru: химия,получение гидроксида алюминия
По отношению к воде алюминий вполне устойчив. Но если механическимпутем или амальгамированием снять предохраняющее действие оксидной пленки, то происходит энергичная реакция: 2Al + 6h3O = 2Al(OH)3 + 3h3 При действии на алюминий водных растворов щелочей слой оксида растворяется, причем образуются алюминаты — соли, содержащие алюминий в составе аниона: Al2O3 + 2NaOH + 3h3O = 2Na[Al(OH)4] Алюминий, лишенный защитной пленки, взаимодействует с водой, вытесняя из нее водород: 2Al + 6h3O = 2Al(OH)3 + 3h3( Образующийся гидроксид алюминия реагирует с избытком щелочи, образуя гидроксоалюминат: Al(OH)3 + NaOH = Na[Al(OH)4]
Самое простое — прилить небольшое к-во щелочи к раствору хлорида Al: AlCl3 + 3NaOH -> Al(OH)3 + 3 NaCl
Гидрокси́д алюми́ния, вещество с формулой ~\mathrm{Al(OH)_3} (а также ~\mathrm{H_3AlO_3}, ~\mathrm{HAlO_2} и ~\mathrm{[Al_2O_3 \cdot H_2O] \cdot n H_2O}) — соединение оксида алюминия с водой. Белое студенистое вещество, плохо растворимое в воде, обладает амфотерными свойствами. Получают при взаимодействии солей алюминия с водными растворами щёлочи, избегая их избытка: \mathrm{AlCl_3 + 3 \ NaOH \longrightarrow \ Al(OH)_3 \downarrow + 3 \ NaCl} Свежеосаждённый гидроксид алюминия способен взаимодействовать с: кислотами \mathrm{Al(OH)_3 + 3 \ HCl \longrightarrow \ AlCl_3 + 3 \ H_2O} щелочами \mathrm{Al(OH)_3 + \ NaOH \longrightarrow \ Na[Al(OH)_4]} Высушенный гидроксид алюминия — представляет собой белое кристаллическое вещество, нерастворимое в кислотах и щёлочах.По отношению к воде алюминий вполне устойчив. Но если механическимпутем или амальгамированием снять предохраняющее действие оксидной пленки, то происходит энергичная реакция: 2Al + 6h3O = 2Al(OH)3 + 3h3 При действии на алюминий водных растворов щелочей слой оксида растворяется, причем образуются алюминаты — соли, содержащие алюминий в составе аниона: Al2O3 + 2NaOH + 3h3O = 2Na[Al(OH)4] Алюминий, лишенный защитной пленки, взаимодействует с водой, вытесняя из нее водород: 2Al + 6h3O = 2Al(OH)3 + 3h3( Образующийся гидроксид алюминия реагирует с избытком щелочи, образуя гидроксоалюминат: Al(OH)3 + NaOH = Na[Al(OH)4]
touch.otvet.mail.ru
Гидроксид алюминия — WiKi
Гидрокси́д алюми́ния — вещество с формулой Al(OH)3 (а также H3AlO3) — соединение оксида алюминия с водой. Белое студенистое вещество, плохо растворимое в воде, обладает амфотерными свойствами.
 Гидроксид алюминия
Гидроксид алюминияПолучение
Al(OH)3 получают при взаимодействии солей алюминия с водными растворами щёлочи, избегая их избытка:
AlCl3+3NaOH⟶Al(OH)3↓+3NaCl{\displaystyle {\mathsf {AlCl_{3}+3NaOH\longrightarrow Al(OH)_{3}\downarrow +3NaCl}}}
Гидроксид алюминия выпадает в виде белого студенистого осадка.
Второй способ получения гидроксида алюминия — взаимодействие водорастворимых солей алюминия с карбонатами щелочных металлов:
- 2AlCl3+3Na2CO3+3h3O→2Al(OH)3↓+6NaCl+3CO2{\displaystyle {\mathsf {2AlCl_{3}+3Na_{2}CO_{3}+3H_{2}O\rightarrow 2Al(OH)_{3}\downarrow +6NaCl+3CO_{2}}}}
Физические свойства
Гидроксид алюминия представляет собой белое кристаллическое вещество, для которого известны 4 кристаллические модификации:
- моноклинный (γ) гиббсит
- триклинный (γ’) гиббсит (гидрагилит)
- байерит (γ)
- нордстрандит (β)
Существует также аморфный гидроксид алюминия переменного состава Al2O3•nH2O
Химические свойства
Свежеосаждённый гидроксид алюминия может взаимодействовать с:
- Al(OH)3+3HCl⟶AlCl3+3h3O{\displaystyle {\mathsf {Al(OH)_{3}+3HCl\longrightarrow AlCl_{3}+3H_{2}O}}}
- В растворах:
- Al(OH)3+NaOH⟶Na[Al(OH)4]{\displaystyle {\mathsf {Al(OH)_{3}+NaOH\longrightarrow Na[Al(OH)_{4}]}}}
- При сплавлении:
- Al(OH)3+NaOH→NaAlO2+2h3O{\displaystyle {\mathsf {Al(OH)_{3}+NaOH\rightarrow NaAlO_{2}+2H_{2}O}}}
При нагревании разлагается:
- 2Al(OH)3→Al2O3+3h3O{\displaystyle {\mathsf {2Al(OH)_{3}\rightarrow Al_{2}O_{3}+3H_{2}O}}}
С растворами аммиака не реагирует.
Безопасность
ЛД50
>5000 мг/кг (крысы, орально)
NFPA 704
Применение
Гидроксид алюминия используется при очистке воды, так как обладает способностью адсорбировать различные вещества, в медицине, в качестве антацидного средства[1], в качестве адъюванта при изготовлении вакцин[2]. Применяется в качестве антипирена (подавителя горения) в пластиках и других материалах.
После обработки до окислов применяется в качестве носителя для катализаторов[3].
Примечания
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1 (Абл-Дар). — 623 с.
ru-wiki.org
Гидроксид алюминия — яркий представитель амфотерных гидроксидов :: SYL.ru
Одним из наиболее широко используемых в промышленности веществ является гидроксид алюминия. В этой статье о нем и пойдет речь.
Что такое гидроксид?
Это химическое соединение, которое образуется при взаимодействии оксида с водой. Существует три их разновидности: кислотные, основные и амфотерные. Первые и вторые разделяются на группы в зависимости от их химической активности, свойств и формулы.
Что такое амфотерные вещества?
Амфотерными могут быть оксиды и гидроксиды. Это такие вещества, для которых характерно проявлять как кислотные, так и основные свойства, в зависимости от условий реакции, используемых реагентов и т. д. К амфотерным оксидам относятся два вида оксида железа, оксид марганца, свинца, бериллия, цинка, а также алюминия. Последний, кстати, чаще всего получают из его гидроксида. К амфотерным же гидроксидам можно отнести гидроксид бериллия, железа, а также гидроксид алюминия, который мы сегодня и рассмотрим в нашей статье.
Физические свойства гидроксида алюминия
Данное химическое соединение представляет собой твердое белое вещество. Оно не растворяется в воде.
Гидроксид алюминия — химические свойства
Как уже было сказано выше, это наиболее яркий представитель группы амфотерных гидроксидов. В зависимости от условий реакции, он может проявлять как основные, так и кислотные свойства. Данное вещество способно растворяться в кислотах, при этом образуется соль и вода.  К примеру, если смешать его с хлорной кислотой в равном количестве, то получим алюминий хлорид с водой также в одинаковых пропорциях. Также еще одно вещество, с которым реагирует гидроксид алюминия, — гидроксид натрия. Это типичный основной гидроксид. Если смешать в равных количествах рассматриваемое вещество и раствор гидроксида натрия, то получим соединение под названием тетрагидроксоалюминат натрия. В его химической структуре содержится атом натрия, атом алюминия, по четыре атома оксигена и гидрогена. Однако при сплавлении этих веществ реакция идет несколько по-другому, и образуется уже не это соединение. В результате данного процесса можно получить метаалюминат натрия (в его формулу входят по одному атому натрия и алюминия и два атома оксигена) с водой в равных пропорциях, при условии, если смешать одинаковое количество сухих гидроксидов натрия и алюминия и подействовать на них высокой температурой. Если же смешать его с гидроксидом натрия в других пропорциях, можно получить гексагидроксоалюминат натрия, который содержит три атома натрия, один атом алюминия и по шесть оксигена и гидрогена. Для того чтобы образовалось данное вещество, нужно смешать рассматриваемое вещество и раствор гидроксида натрия в пропорциях 1:3 соответственно. По описанному выше принципу можно получить соединения под названием тетрагидроксоалюминат калия и гексагидроксоалюминат калия. Также рассматриваемое вещество подвержено разложению при воздействии на него очень высоких температур. Вследствие такого рода химической реакции образуется оксид алюминия, который также обладает амфотерностью, и вода. Если взять 200 г гидроксида и нагреть его, то получим 50 г оксида и 150 г воды. Кроме своеобразных химических свойств, данное вещество проявляет также и обычные для всех гидроксидов свойства. Оно вступает во взаимодействие с солями металлов, которые имеют более низкую химическую активность, нежели алюминий. Для примера можно рассмотреть реакцию между ним и хлоридом меди, для которой нужно взять их в соотношении 2:3. При этом выделится водорастворимый хлорид алюминия и осадок в виде гидроксида купрума в пропорциях 2:3. Также рассматриваемое вещество реагирует и с оксидами подобных металлов, для примера можно взять соединение той же меди. Для проведения реакции потребуется гидроксид алюминия и оксид купрума в соотношении 2:3, в результате чего получим алюминий оксид и гидроксид меди. Свойствами, которые были описаны выше, также обладают и другие амфотерные гидроксиды, такие как гидроксид железа или бериллия.
К примеру, если смешать его с хлорной кислотой в равном количестве, то получим алюминий хлорид с водой также в одинаковых пропорциях. Также еще одно вещество, с которым реагирует гидроксид алюминия, — гидроксид натрия. Это типичный основной гидроксид. Если смешать в равных количествах рассматриваемое вещество и раствор гидроксида натрия, то получим соединение под названием тетрагидроксоалюминат натрия. В его химической структуре содержится атом натрия, атом алюминия, по четыре атома оксигена и гидрогена. Однако при сплавлении этих веществ реакция идет несколько по-другому, и образуется уже не это соединение. В результате данного процесса можно получить метаалюминат натрия (в его формулу входят по одному атому натрия и алюминия и два атома оксигена) с водой в равных пропорциях, при условии, если смешать одинаковое количество сухих гидроксидов натрия и алюминия и подействовать на них высокой температурой. Если же смешать его с гидроксидом натрия в других пропорциях, можно получить гексагидроксоалюминат натрия, который содержит три атома натрия, один атом алюминия и по шесть оксигена и гидрогена. Для того чтобы образовалось данное вещество, нужно смешать рассматриваемое вещество и раствор гидроксида натрия в пропорциях 1:3 соответственно. По описанному выше принципу можно получить соединения под названием тетрагидроксоалюминат калия и гексагидроксоалюминат калия. Также рассматриваемое вещество подвержено разложению при воздействии на него очень высоких температур. Вследствие такого рода химической реакции образуется оксид алюминия, который также обладает амфотерностью, и вода. Если взять 200 г гидроксида и нагреть его, то получим 50 г оксида и 150 г воды. Кроме своеобразных химических свойств, данное вещество проявляет также и обычные для всех гидроксидов свойства. Оно вступает во взаимодействие с солями металлов, которые имеют более низкую химическую активность, нежели алюминий. Для примера можно рассмотреть реакцию между ним и хлоридом меди, для которой нужно взять их в соотношении 2:3. При этом выделится водорастворимый хлорид алюминия и осадок в виде гидроксида купрума в пропорциях 2:3. Также рассматриваемое вещество реагирует и с оксидами подобных металлов, для примера можно взять соединение той же меди. Для проведения реакции потребуется гидроксид алюминия и оксид купрума в соотношении 2:3, в результате чего получим алюминий оксид и гидроксид меди. Свойствами, которые были описаны выше, также обладают и другие амфотерные гидроксиды, такие как гидроксид железа или бериллия.
Что такое гидроксид натрия?
Как видно выше, существует много вариантов химических реакций гидроксида алюминия с гидроксидом натрия. Что же это за вещество? Это типичный основной гидроксид, то есть химически активная, растворимая в воде основа. Он обладает всеми химическими свойствами, которые характерны для основных гидроксидов.  То есть он может растворяться в кислотах, к примеру, при смешивании натрий гидроксида с хлорной кислотой в равных количествах можно получить пищевую соль (хлорид натрия) и воду в пропорции 1:1. Также данный гидроксид вступает в реакции с солями металлов, которые обладают более низкой химической активностью, нежели натрий, и их оксидами. В первом случае происходит стандартная реакция обмена. При добавлении к нему, к примеру, хлорида серебра, образуется хлорид натрия и гидроксид серебра, который выпадает в осадок (реакция обмена осуществима только в случае, если одно из веществ, полученных в ее результате, будет осадком, газом либо водой). При добавлении к натрий гидроксиду, например, оксида цинка, получаем гидроксид последнего и воду. Однако намного более специфическими являются реакции данного гидроксида AlOH, которые были описаны выше.
То есть он может растворяться в кислотах, к примеру, при смешивании натрий гидроксида с хлорной кислотой в равных количествах можно получить пищевую соль (хлорид натрия) и воду в пропорции 1:1. Также данный гидроксид вступает в реакции с солями металлов, которые обладают более низкой химической активностью, нежели натрий, и их оксидами. В первом случае происходит стандартная реакция обмена. При добавлении к нему, к примеру, хлорида серебра, образуется хлорид натрия и гидроксид серебра, который выпадает в осадок (реакция обмена осуществима только в случае, если одно из веществ, полученных в ее результате, будет осадком, газом либо водой). При добавлении к натрий гидроксиду, например, оксида цинка, получаем гидроксид последнего и воду. Однако намного более специфическими являются реакции данного гидроксида AlOH, которые были описаны выше.
Получение AlOH
Когда мы уже рассмотрели основные его химические свойства, можно поговорить о том, как же его добывают. Основной способ получения данного вещества — проведение химической реакции между солью алюминия и натрий гидроксидом (может использоваться и калий гидроксид). При такого рода реакции образуется сам AlOH, выпадающий в белый осадок, а также новая соль. Например, если взять алюминий хлорид и добавить к нему в три раза больше гидроксида калия, то полученными веществами будут рассматриваемое в статье химическое соединение и в три раза больше хлорида калия. Также существует метод получения AlOH, который предусматривает проведение химической реакции между раствором соли алюминия и карбонатом основного металла, для примера возьмем натрий. Для получения гидроксида алюминия, кухонной соли и углекислого газа в пропорциях 2:6:3 необходимо смешать хлорид алюминия, карбонат натрия (соду) и воду в соотношении 2:3:3.
При такого рода реакции образуется сам AlOH, выпадающий в белый осадок, а также новая соль. Например, если взять алюминий хлорид и добавить к нему в три раза больше гидроксида калия, то полученными веществами будут рассматриваемое в статье химическое соединение и в три раза больше хлорида калия. Также существует метод получения AlOH, который предусматривает проведение химической реакции между раствором соли алюминия и карбонатом основного металла, для примера возьмем натрий. Для получения гидроксида алюминия, кухонной соли и углекислого газа в пропорциях 2:6:3 необходимо смешать хлорид алюминия, карбонат натрия (соду) и воду в соотношении 2:3:3.
Где используется алюминий гидроксид?
Гидроксид алюминия находит свое применение в медицине. Благодаря его способности нейтрализовать кислоты, препараты с его содержанием рекомендуются при изжоге. Также его выписывают при язвах, острых и хронических воспалительных процессах кишечника. Кроме того, гидроксид алюминия используют в изготовлении эластомеров. Также он широко применяется в химической промышленности для синтеза оксида алюминия, алюминатов натрия — эти процессы были рассмотрены выше. Кроме того, его часто используют во время очистки воды от загрязнений. Также данное вещество широко применяется в изготовлении косметических средств.
Благодаря его способности нейтрализовать кислоты, препараты с его содержанием рекомендуются при изжоге. Также его выписывают при язвах, острых и хронических воспалительных процессах кишечника. Кроме того, гидроксид алюминия используют в изготовлении эластомеров. Также он широко применяется в химической промышленности для синтеза оксида алюминия, алюминатов натрия — эти процессы были рассмотрены выше. Кроме того, его часто используют во время очистки воды от загрязнений. Также данное вещество широко применяется в изготовлении косметических средств.
Где применяются вещества, которые можно получить с его помощью?
Оксид алюминия, который может быть получен вследствие термического разложения гидроксида, используется при изготовлении керамики, применяется в качестве катализатора для проведения разнообразных химических реакций. Тетрагидроксоалюминат натрия находит свое использование в технологии окрашивания тканей.
www.syl.ru
Гидрат оксида алюминия и гидроксид алюминия
При добавлении водного раствора аммиака в растворам солей алюминия выпадает гелеобразный осадок, состоящий (если осаждение идет на холоду) вначале из гидрогеля аморфного оксида алюминия, который в соприкосновении с раствором медленно (при нагревании значительно быстрее) превращается в кристаллический гидроксид, а именно в метагидроксид алюминия АlO(ОН). Метагидроксид получают также (обычно в смеси с аморфным гидрогелем оксида алюминия) при кипячении соли алюминия с веществами, способными при гидролизе связывать ионы Н—, например, с карбонатами, ацетатами, тиосульфатами и т. д. С избытком щелочи осадка не образуется, так как при высокой концентрации гидроксильных ионов происходит образование легкорастворимых гидроксоалюминатов.
Осадок, образующийся при осаждении из кислых растворов, содержащий переменное количество воды и обладающий в большинстве случаев различной природой, называется оксигидратом в противоположность гидроксида вполне определенного состава — ортогидроксида алюминия А1(ОН)3 и метагидроксида алюминия АlO(ОН).
Гидроксид алюминия А1(ОН)3 получается в виде белого осадка, обладающего по рентгенографическим данным кристаллическими свойствами в том случае, если осаждение вели из алюминатных растворов, например, при пропускании диоксида углерода:
2[Al(OH)4]— + CO2 → 2Al(OH)3 + CO32- + H2O
В природе гидроксид алюминия А1(ОН)3 существует в виде моноклинного гидраргиллита. Кристаллический гидроксид (уд. вес 2,42) в отличие, от аморфного оксигидрата в кислотах растворяется с трудом. При многочасовом нагревании до 100 ºС кристаллический гидроксид алюминия, опять-таки в отличие от аморфного оксигидрата, не теряет воды. Но при более длительном нагревании, например, в течение 14 суток, в запаянной ампуле при 150 °С орто-гидроксид переходит в содержащую меньше воды, но также кристаллический метагидроксид АlO(ОН), которая в природе встречается в больших количествах в виде боксита, получившего свое название от города Ле-Бо (Франция), вблизи которого были открыты большие залежи этого минерала. Боксит образуется при разложении ажюмосиликатных пород в тропическом климате, тогда как вне тропиков разложение тех же пород приводит главным образом к образованию каолина. Искусствеппо приготовленная кристаллический метагидроксид называется в отличие от минерала боксита бемитом.
Гидроксид алюминия является исходным продуктом для получения других солей алюминия, особенно сульфатов, а также для приготовления чистого оксида алюминия, пригодного для электролитического получения из него металлического алюминия. Гидроксид алюминия для превращения в оксид, пригодного для этой цели, необходимо сильно прокаливать, чтобы предотвратить поглощение ним воды из воздуха при охлаждении. Аморфный гидрат оксида алюминия, осаждающийся на холоду из водных растворов солей алюминия, находит также техническое применение.
Боксит применяют не только для производства алюминия, но и для изготовления огнеупорных бокситовых кирпичей, получаемых обжигом смеси боксита и глины.
Ваш отзыв
Вы должны войти, чтобы оставлять комментарии.
khimie.ru
6)Оксид и гидроксид алюминия. Получение и свойства
Оксид алюминия – Al2O3. Физические свойства: оксид алюминия – белый аморфный порошок или очень твердые белые кристаллы.
Получение: оксид алюминия получают методом восстановления алюминием металлов из их оксидов: хрома, молибдена, вольфрама, ванадия и др. – металлотермия, открытый Бекетовым:
Cr2O3 + Al = Al2O3 + 2Cr
Химические свойства:
Оксид алюминия проявляет амфотерные свойства
1. взаимодействие с кислотами
А12О3 +6HCl = 2AlCl3 + 3h3O
2. взаимодействие со щелочами
А12О3 + 2NaOH – 2NaAlO2 + h3O
Al2O3 + 2NaOH + 5h3O = 2Na[Al(OH)4(h3O)]
3. при накаливании смеси оксида соответствующего металла с порошком алюминия происходит бурная реакция, ведущая к выделению из взятого оксида свободного металла. Метод восстановления при помощи Al (алюмотермия) часто применяют для получения ряда элементов (Cr, Мп, V, W и др.) в свободном состоянии
2А1 + WO3 = А12Оз + W
4. взаимодействие с солями, имеющими сильнощелочную среду, вследствие гидролиза
Al2O3 + Na2CO3 = 2 NaAlO2 + CO2
Гидроксид алюминия – А1(ОН)3. Физические свойства: гидроксид алюминия – белы, аморфный (гелеобразный) или кристаллический. Почти не растворим в воде;
Получение:
1) из солей алюминия под действием раствора щелочей: AlСl3 + 3NaOH = Al(ОН)3 + 3Н2О;
2) разложением нитрида алюминия водой: AlN + 3Н2О = Аl(ОН)3 + NН3?;
3) пропусканием СО2 через раствор гидроксокомплекса: [Аl(ОН)4]-+ СО2 = Аl(ОН)3 + НСО3-;
4) действием на соли Аl гидратом аммиака; при комнатной температуре образуется Аl(ОН)3.
Химические свойства:
1. взаимодействие с кислотами
Al(OH)3 +3HCl = 2AlCl3 + 3h3O
2. при взаимодействии с сильными щелочами образуются соответствующие алюминаты:
NaOH + А1(ОН)з = Na[A1(OH)4]
3. термическое разложение
2Al(OH)3 = Al2О3 + 3h3O
Гидроксид алюминия не реагирует с гидратом аммиака, хлоридомаммония, диоксидами углерода и серы, сероводородом.
7.Амфотерность оксида и гидроксида алюминия. Комплексные соединения алюминия.
Al2O3 – твердое вещество белого цвета, тугоплавкое. Не реагирует с водой и не растворяется.
Типичный амфотерный оксид, поэтому реагирует с кислотами и щелочами.
Al2O3 + 6 HCl = 2 AlCl3 + 3 H2O
При сплавлении образуется метаалюминат натрия:
Al2O3 (тв)+ 2 NaOH (тв) t→ 2 NaAlO2 + H2O,
В растворе щёлочи образуется тетрагидроксоалюминат натрия:
Al2O3 + 2 NaOH + 3 H2O = 2Na[Al(OH)4]
Алюминаты неустойчивы и даже при слабом подкислении разрушаются:
Na[Al(OH)4] + CO2 = Al(OH)3 + NaHCO3
Al(OH)3 – белое вещество, нерастворимое в воде, амфотерный гидроксид.
Получают косвенно реакцией обмена между солью алюминия и щелочью:
AlCl3 + NaOH (по каплям)= Al(OH)3 ↓ + 3 NaCl
Взаимодействует с кислотами и щелочами.
Al(OH)3 + 3 HCl = AlCl3 + 3 H2O
В растворе: Al(OH)3 + NaOH(избыток) = Na[Al(OH)4]
или Al(OH)3 + 3 NaOH = Na3[Al(OH)6]
В расплавах: Al(OH)3 + NaOH = NaAlO2 + 2H2O
Очень часто амфотерные гидроксиды элементов в степени окисления +III существуют также в мета-форме, например:
AlO(OH) — метагидроксид алюминия
FeO(OH) — метагидроксид железа (орто-форма «Fe(OH)3» не существует).
Амфотерные гидроксиды практически нерастворимы в воде, наиболее удобный способ их получения — осаждение из водного раствора с помощью слабого основания — гидрата аммиака:
Al(NO3)3 + 3(Nh4 · h3O) = Al(OH)3↓ + 3Nh5NO3 (20 °C)
Al(NO3)3 + 3(Nh4 · h3O) = AlO(OH)↓ + 3Nh5NO3 + h3O (80 °C)
В случае использования избытка щелочей в обменной реакции подобного типа гидроксид алюминия осаждаться не будет, поскольку алюминий в силу своей амфотерности переходит в анион:
Al(OH)3(т) + OH− = [Al(OH)4]−
Пример молекулярного уравнения реакции этого типа:
Al(NO3)3 + 4NaOH(избыток) = Na[Al(OH)4] + 3NaNO3
Образующаяся соль относится к числу комплексных соединений (комплексных солей): они включают комплексный анион [Al(OH)4]−. Названия этой соли таково:
Na[Al(OH)4] — тетрагидроксоалюминат натрия
Растворение амфотерных гидроксидов в щелочных растворах рассматривается как процесс образования гидроксосолей (гидроксокомплексов). Экспериментально доказано существование гидроксомплексов [Аl(ОН)4(Н2О)2]—, [Аl(ОН)6]3-, [Аl(ОН)5(Н2O)]2-; из них первый — наиболее прочный. Координационное число алюминия в этом комплексе равно 6, т.е. алюминий является шестикоординированным.
Комплексным (координационным) соединением (комплексом) называется такое соединение, в узлах кристаллической решетки которого находятся комплексные ионы, обладающие высокой симметрией, устойчивые как в твердом состоянии, так и в растворах. В центре комплексного иона находится металл (обычно d-металл, реже р-металл), который называется комплексообразователь. Вокруг него очень симметрично располагаются лиганды, за счет чего электронная плотность распределяется равномерно и комплекс становится устойчивым. Лигандами могут быть анионы кислот или нейтральные молекулы (Н2О, СО, NH3), которые имеют неподеленную пару электронов. Она принимает участие в донорно-акцепторном взаимодействии с вакантной орбиталью комплексообразователя.
studfiles.net
