ГИПОХЛОРИТ НАТРИЯ
Технология минеральных солей (удоБрений, пестицидов, промышленных солей, окислов и кислот)
Чистый раствор NaCIO можно получить нейтрализацией хлорноватистой кислоты щелочью или взаимодействием СЮг в толуоле с NaOH и Н20 2 99. Слабые растворы хлорноватистой кислоты с содержанием 3—5% НСЮ могут быть получены 100 хлорированием или суспензии желтой окиси ртути в воде при 0°, или водной суспензии СаСОз при 0, —5°.
Технические растворы гипохлорита натрия всегда содержат также хлорид натрия. Их получают: взаимодействием хлорной извести с раствором соды или сульфата натрия, хлорированием раствора NaOH или Na2C03 и электролизом раствора поваренной соли.
При растворении хлорной извести в избытке воды составляющие ее сложные соединения распадаются* растворимые соли — Са(С10)2 и СаС12 — переходят в раствор, а известь остается в Осадке.
В присутствии в растворе соды или сульфата натрия происходит обменное разложение с выделением в твердую фазу СаСО»
ЙЛИ CaSC>4 И образованием в растворе NaCIO И NaCl: Са(СЮ)г + Na2C03 = 2NaC10 + CaC03 Ca(CIO)2 + Na2S04 = 2NaC10 + CaS04
Одновременно протекают реакции взаимодействия NaaCOs или Na2S04 с СаСЬ. Процесс следует вести94 при температуре не выше 30—35° во избежание хлоратного распада. Полученный после отстаивания осадков раствор содержит NaCIO и NaCl.
Представляет интерес получение раствора NaCIO пропусканием раствора Са(СЮ)г, содержащего около 5% активного хлора, через слой катионита, регенерируемого водой, а затем 15% раствором NaCl 101.
Хлорирование растворов NaOH или №2СОз проводят или путем барботажа хлора через раствор щелочи в бетонных резервуарах, или в башнях с насадкой, орошаемой циркулирующим щелочным раствором. Используют также абсорберы с мешалками и охлаждающими змеевиками из полиэтилена 102. Для этой цели предложены также аппараты в виде двух концентрических труб 103, барботеры с тангенциальным вводом жидкости с целью придания ей вращательного движения104, барботер и расположенный над ним кожухотрубный теплообменник, смонтированные в одном корпусе I0S, струйные инжекторы для смешения раствора с хлором с завершением реакции в башне с насадкой 106.
Растворы едкого натра берут с концентрацией до 30% NaOH. При хлорировании их выделяется значительное количество тепла: 2NaOH + CI2 = NaCIO + NaCl + Н20 + 25 ккал
Во избежание повышения температуры выше 35°, особенно в конце процесса, абсорбцию хлора ведут медленно, чтобы щелок успевал охладиться естественным путем, или применяют искусственное его охлаждение.
С целью предупреждения повышения температуры рекомендуют вести процесс при пониженном давлении107, например, при 15—20 мм рт. ст., когда тепло реакции отводится за счет выпаривания воды.
Предотвращение разложения гипохлорита натрия достигается также наличием в растворе свободной щелочиш. Процесс ведут при избытке щелочи не менее 0,8 вес. ч. свободной NaOH на 1 вес. ч. NaCIO. Возможно также применение добавки к щелочным растворам гипохлорита (содержащим 80—90
При получении гипохлорита натрия хлорированием растворов соды процесс ведут по реакции:
2Na2C03 + С12 + Н20 = NaCIO + NaCl + 2NaHC03
Дальнейшее хлорирование приводит к взаимодействию NaHC03 с СЬ и выделению СОг и НС10. Двуокись углерода выделяет из гипохлорита НСЮ, а свободная хлорноватистая кислота разлагает гипохлорит (см. выше). При этом происходит почти полная потеря активного хлора. Поэтому хлорирование раствора соды заканчивают до начала выделения двуокиси углерода.
Электролитическое получение раствора гипохлорита натрия осуществляют электролизом раствора поваренной соли в ваннах без диафрагмы. При этом хлор, выделяющийся на аноде, реагирует с едким натром, образующимся на катоде. Во избежание образования хлората натрия вследствие окисления на аноде ионов СЮ — по мере их накопления, электролиз ведут в условиях минимального перенапряжения при выделении хлора и низкой концентрации ионов С10~ в прианодном электролите. Для уменьшения скорости разложения гипохлорита натрия процесс ведут при 20—25°, охлаждая циркулирующий раствор электролита. Электродами служат платино-иридиевые сетки ш. Можно также применять графитовые аноды и катоды. Электролиз проводят при плотности тока до 1400 а/см2 и напряжении между электродами 3,7—4,2 в. В рассол добавляют хлорид кальция и ализариновое или канифольное масло (^—-0,1%) для предотвращения катодного восстановления. Выход по току по мере накопления активного хлора до 10—12% г/л уменьшается от 95% в начале процесса до 50—55%. При начальной концентрации раствора 100—120 г/л NaCl и содержании в конечном растворе 15—20 г/л активного хлора расход энергии составляет 5,5—б
Разработана 112 конструкция электролизера с засыпными электродами из зерен природного магнетита. В нижней и верхней частях слоя магнетита расположены токоподводящие электроды из нержавеющей стали, служащие катодами и анодами. Для электролиза применяют циркулирующие растворы, содержащие ~30 г/л NaCl. Для этого можно использовать как искусственные растворы, так и морскую воду и другие природные соляные рассолы.
При взаимодействии хлорита натрия с хлором происходит образование хлористого натрия и выделяется двуокись хлора: 2NaC102 + С12 = 2NaCl + 2 СЮ2 Этот способ ранее был основным для получения двуокиси …
На рис. 404 представлена схема производства диаммонитро — фоски (типа TVA). Фосфорная кислота концентрацией 40—42,5% Р2О5 из сборника 1 насосом 2 подается в напорный бак 3, из которого она непрерывно …
Физико-химические свойства Сульфат аммония (Nh5)2S04 — бесцветные кристаллы ромбической формы с плотностью 1,769 г/см3. Технический сульфат аммония имеет серовато-желтоватый оттенок. При нагревании сульфат аммония разлагается с потерей аммиака, превращаясь в …
msd.com.ua
Получение натрия электролизом поваренной соли
Электролитически полученный гипохлорит натрия целесообразно применять в тех случаях, когда доставка хлорной извести и хлора или их храпение затруднены, а вопрос получения электроэнергии и поваренной соли легко разрешим. Для приготовления растворов гипохлорита натрия непосредственно на водопроводах станции обработки воды оборудуются установками, в которых готовится 10—15%-ный раствор поваренной соли и проводится его электролиз в ваннах без диафрагмы. В состав [c.150]Наиболее совершенный аппарат для, непосредственного получения натрия из поваренной соли — ванна Даунса. Эта ванна служит для электролиза поваренной соли с добавлением хлорида кальция. В ней имеются 1) хорошее разделение анодного и катодного пространства во избежание попадания натрия на анод 2) специальное устройство для быстрой и полной выгрузки получаемого натрия из ванны 3) предварительная подсушка загружаемой соли, содержащей влагу, до поступления в зону электролиза. [c.313]
Получение хлора и едкого натра электролизом поваренной соли может служить примером электрохимического производства. [c.112]
Промышленным методом получения натрия в настоящее время является исключительно электролиз его расплавленных соединений— едкого натра или поваренной соли. До 1925 г. почти 100% натрия получали электролизом расплавленного каустика. Но уже в 1930 г. этим методом было выпущено лишь 50% мирового производства натрия. Остальные 50% получали из поваренной соли. В 1940 г. эти доли составляли соответственно 15 и 85%, а в 1952 г. —5 и 95%. [c.303]
Хлоридные электролиты, используемые для получения натрия, требуют предварительного обезвоживания, так как СаСЬ весьма гигроскопичен. Наличие даже незначительных количеств влаги ведет к быстрому разрушению графитовых анодов из-за выделения кислорода. Поэтому технологическая схема получения натрия из поваренной соли состоит из стадий подготовки соли и электролиза. Обычно кроме этих двух стадий имеются также стадии рафинирования натрия-сырца и подготовки анодного хлора для потребителя. [c.521]
В настоящее время в практику водоснабжения внедряется хлорирование воды гипохлоритом натрия, полу- чаемым электролитическим способом на месте потребления путем электролиза концентрированного раствора поваренной соли. Электролитический способ приготовления гипохлорита натрия основан на получении хлора и его взаимодействии со щелочью в одном и том же аппарате— электролизере. При электролизе поваренной соли на [c.72]
Хлоридные электролиты, используемые для получения натрия, требуют предварительного обезвоживания, так как СаСЬ весьма гигроскопичен. Наличие даже незначительных количеств влаги приводит к быстрому разрушению графитовых анодов из-за выделения кислорода. Поэтому технологическая схема получения натрия из поваренной соли состоит из стадий подготовки соли и электролиза. Обычно, кроме этих двух стадий, имеются также стадии рафинирования натрия-сырца и подготовки анодного хлора для выдачи потребителю. Подготовка солей заключается в подсушке поваренной соли и в прокаливании при 2OO °С смеси солей, добавляемых к электролиту. [c.494]
Работа 2. Получение едкого натра электролизом поваренной соли [c.211]
Промышленные установки для получения натрия электролизом расплавленной поваренной соли появились в 1910 г., а в период 1915—1925 гг. солевой способ начал получать распространение. Химические способы постепенно утратили свое значение. [c.302]
Проблема замены дорогого сырья — едкого натра — в производстве натрия более дешевой и распространенной в природе поваренной солью возникла еще до появления патента Кастнера и интенсивно разрабатывалась после введения каустического способа в практику. Первые опыты по получению натрия электролизом расплавленной поваренной соли проводились еще Фарадеем в 1833 г. Однако его процесс оказался технически весьма сложным и только почти через 70 лет, благодаря упорной работе многих исследователей, удалось осуществить его в заводских условиях. [c.311]
В условиях военного времени быстрота и простота получения гипохлорита натрия электролизом поваренной соли приобретают исключительное значение для использования этого процесса при обезвреживании водн на всех водопроводах, куда легко может быть завезена соль и где имеется электроэнергия. На крупных водопроводах возможно также получение хлора в специальных ваннах, хотя эксплоатация их несколько сложнее. [c.289]
Изложенное выше убеждает, что современные методы очистки и обеззараживания бытовых сточных вод недостаточны,чтобы обеспечить инфекционную безопасность поверхностных водоемов. Права Г. А. Багдасарьян [2], считающая, что необходима разработка специальных методов очистки сточных вод от вирусов и введение в практику дополнительного санитарно-вирусологического контроля очищенных стоков, поступающих в открытые водоемы, или подбор санитарно-показательных микроорганизмов, соответствующих по устойчивости вирусам . В связи с этим, заслуживает внимания сообщение Л. А. Сергуниной [53], показавшей эффективность обеззараживания воды с помощью гипохлорита натрия, полученного путем электролиза поваренной соли. Вполне возможно, что изучавшийся ею метод может стать одним из наиболее целесообразных для обеззараживания бытовой сточной жидкости после биологической очистки.
Рассол, полученный растворением природной поваренной соли, обычно содержит примеси солей кальция, магния, железа, а также механические взвеси песка, глины и т. п. Поскольку присутствие указанных примесей в растворе хлористого натрия отрицательно сказывается на процессе электролиза, перед подачей на электролиз раствор подвергают тщательной очистке. [c.25]
Нри выработке хлора и едкого натра методом электролиза поваренной соли используют катоды из металлической ртути. Для получения тонны едкого натра нужно от 125 до 400 г злемента № 80. Сегодня хлорная промышленность — один из самых массовых потребителей металлической ртути. [c.243]
При выработке хлора и едкого натра методом электролиза поваренной соли используют катоды из металлической ртути. Для получения тонны едкого натра нужно [c.205]
Какие примеси могут сопутствовать едкому натру, полученному электролизом поваренной соли Как их обнаружить [c.437]
Химические способы получения двуокиси хлора основаны на обработке хлората натрия серной или соляной кислотами. При этом образуется хлорноватая кислота, в результате превращений которой возникает двуокись хлора. Эти способы неудобны тем, что в результате взаимодействия хлората натрия с упомянутыми минеральными кислотами в качестве побочных продуктов возникает сульфат натрия или поваренная соль. Применив электролиз, можно избавиться от образования этих продуктов. [c.114]
Все растворы (щелока), полученные при электролизе поваренной соли в диафрагменных ваннах с твердым катодом, а также ферритным и известковым способами, икеют низкую концентрацию едкого натра и содержат примеси — поваренную соль (в электролитических щелоках) и соду (при химических способах производства каустической соды). Такие растворы не могут быть использованы в производствах, потребляющих едкий натр. Перевозка разбавленных растворов NaOH с примесями соли и соды привела бы к непроизводительным затратам и излишней загрузке транспорта. Так, при транспортировании электролитического щелока на 1 т едкого натра пришлось бы перевозить около 9 т балласта — воды и соли.
Электролиз поваренной соли можно вести в двух направлениях без разделения продуктов электролиза для получения гипохлорита натрия и с разделением их при помощи диафрагмы с получением газообразного хлора. [c.288]
Вследствие распределения металлического натрия в расплаве при высоких температурах вначале не удавались попытки выделить натрий непосредственно при электролизе расплавленной поваренной соли. Однако оказалось, что добавкой, хлористого кальция точку плавления можно значительно понизить, так что электролиз такой смеси можно провести при температурах незначительно выше 600°. На этом основан способ Кибы ( iba, 1910), который осуществил заводское получение натрия электролизом хлорида. Очень удобная камера для проведения этого процесса была сконструирована Даунсом (Downs). Даунс-камера (рис. 31) состоит из каменного сосуда, в который вставлены снизу графитовый стержень А, служащий анодом, и сбоку железные катоды К. Анод покрыт железным кожухом 1, на котором укреплена проволочная сетка 2, разделяющая анодное и катодное пространства. Смесь хлоридов, которая поддерживается в расплавленном состоянии теплом электрического тока, с поверхности покрыта твер- [c.190]
В данном случае электролиз удачно использован для получения в анодном пространстве свободной хлорноватой кислоты. Одновременно в катодном пространстве накапливается щелочь. Побочные продукты, вроде сульфата натрия или поваренной соли, при электролизе не образуются.
В алкиламмониевых солях ион аммония играет ту же роль, что. и натрий в поваренной соли. Поэтому можно предполагать, что свободный аммоний или его алкильные производные по своим химическим свойствам должны быть близки щелочным металлам. Сравнительно давно были предприняты попытки (Муассан) выделить свободные радикалы аммония. Шлубах показал, что тетраэтиламмоний ( 2Hs)4N может быть получен ei растворе в жидком аммиаке, если подвергать электролизу сильно охлажденный раствор иодистого тетраэтиламмония в жидком аммиаке или действовать на хлористый тетраэтиламмоний литием, растворенным в жидком аммиаке [c.165]
При хлорировании органических веществ, в частности, насыщенных углеводородов, около 50% израсходованного хлора превращается в хлористый водород, выделяемый в виде соляной кислоты, не имеющей рыночной ценности. Последнюю, во избежание сброса в канализацию, направляют на регенерацию для получения хлора путем электролиза. Таким образом, достигается циркуляция хлора в замкнутом цикле и уменьшается выход едкого натра в два раза, причем этот способ конкурирует с электролизом поваренной соли [55, 72]. [c.35]
Владимир Ильич Ленин в 1920 г. сказал Мы должны иметь новую техническую базу для нового экономического строительства. Этой новой технической базой является электричество. Мы должны будем на этой базе иметь все . Этот ленинский завет успешно выполняется, и к настоящему времени в нашей стране создана мощная электротехническая база, способствующая развитию всех основных отраслей современной техники, в том числе и крупной электрохимической промышленности. Одним из основных многотоннажных производств последней является получение хлора и каустической соды путем электролиза поваренной соли в ваннах с ртутными катодами. При этом в виде промежуточного продукта образуются огромные количества амальгамы натрия, обладающей сильными восстановительными свойствами. Естественно поэтому, что применение амальгамы натрия для восстановления неорганических и органических соединений является весьма актуальной задачей науки и техники. Решению этой задачи должен помочь обзор по амальгамному гидрированию неорганических и органических соединений, содержащий сводку наиболее интересных реакций, которые могут быть осуществлены с помощью амальгам щелочных металлов, и излагающий современное представление о механизме амальгамного способа восстановления и о возможностях этого метода. Такого полного обзора в химической литературе нет, а по механизму амальгамного восстановления существуют самые противоречивые мнения. [c.3]
Электролитический способ приготовления гипохлорита натрия основан на получении хлора и его взаимодействии со щелочью в одном и том же алпарате — электролизере. При электролизе поваренной соли на катоде разряжаются молекулы воды с выделением водорода [c.176]
Электролизом поваренной соли получают металлический натрий и хлор. Первый сплавляют со свинцом для получения свинцовонатриевого сплава состава 90% свинца и 10% натрия. [c.333]
Агрегат для получения хлора, каустической соды и водорода, называемый ванной с ртутным катодом, состоит из трех частей электролизера, разлагателя и ртутного насоса. Схематическое устройство ванны с ртутным катодом показано на рис. 54. В электролизере 1 в результате электролиза поваренной соли образуются хлор и а.мальгама натрия [c.189]
Описано получение N328, основанное на разложении змзль-гамы натрия, образующейся при электролизе поваренной соли с ртутным катодом, раствором полисульфида нзтрия или серой по реакциям [c.499]
При решении вопроса о добавках к электролиту следует не забывать электрохимических свойств добавляёмых солей. В электролит следует добавлять только соединения более электроотрицательных металлов, в противном случае добавки будут загрязнять получаемый металл. При выборе состава электролита следует сопоставлять его температуру плавления с температурой плавления получаемого металла. Так, если вести получение натрия электролизом чистой поваренной соли (температура плавления 800°), то значительное количество получающегося натрия будет переходить в газообразную фазу (натрий плавится при 98° и кипит при 880°). Как будет показано ниже, при высоких температурах велика растворимость получаемых металлов в электролитах. Поэтому след ет вести электролиз при возможно низких температурах. [c.402]
Практически осуществлено комбинированное восстановление нитробензола амальгамой натрия (0,2%-ной, полученной электролизом поваренной соли) и цинковой пылью. При восстановлении амальгамой, осуществляемом в никелевом аппарате с мешалкой при 70°, нитробензол превращается преимущественно в азобензол. Слой азобензола (содержит около 90% азобензола и 9—11% азо-ксибензола или 7—8% гидразобензола и 2—3% анилина) отделяют от концентрированного раствора едкого натра и переводят в гидразобензол действием цинковой пыли в присутствии раствора едкого натра. Расход цинковой пыли при этом снижается примерно в 5 раз 2 . [c.283]
Исходя из величины разрядных потенциалов хлора и водорода иди теплоты реакции образования хлора, водорода и раствора едкого натра из поваренной соли и воды, по формулам Нернста иди Гельмгольца можно вычислить напряжение разложения раствора хлористого натрия, т. е. минимальное напряжение, необходимое для начала электролиза. В пе])-вом случае при 18″ С для раствора КаС15мол/л (293 г/л) оно оказывается равным 2,16 вольта, во втором случае — 2,18 вольта. Таким образом тео-ретичес1си для получения одного грамм-эквивалента хлора расход электроэнергии составляет 96500×2,16 = 208000 джоулей. [c.291]
Получение натрия электролизом хлорида натрия. При электролитическом получении натрия из расплава Na l возникает ряд трудностей. Основная трудность заключается в том, что температура плавления Na l (800°С) и температура кипения натрия (882,9 С) слишком близки, вследствие чего получаемый натрий испаряется. Кроме того, при 800 °С натрий легко растворяется в расплаве электролита, взаимодействует с футеровкой ванны и разрушает ее. В то же время применение поваренной соли в качестве электролита имеет большие преимущества, обусловленные дешевизной сырья и возможностью использования анодного хлора, поэтому процессу электролиза Na l уделено большое внимание. [c.494]
В 1872 г. Дусарт и Барди показали, что хлорбензол разлагается водным раствором каустической оды на фенолят натрия и поваренную соль при 300 °С. Способ получения фенола подобным образом заключается в электролизе поваренной соли с одновременным хлорированием бензола. Экономически он оправдан только при наличии исходного сырья. [c.20]
Выделение металлического натрия из расплавленной поваренной соли на жидком свинцовом катоде происходит также гораздо эффективнее, чем на твердом катоде [20]. Поэтому было взято несколько патентов на техническое получение натрия электролизом расплавленного Na l с применением жидкого свинцового катода. Известен, например, способ Ашкрофта, который осуществлен в большом масштабе в Норвегии [21]. Электролиз ведут в сдвоенной ванне. В одном отделении расплавленный хлористый натрий подвергается электролизу между угольным анодом и катодом из расплавленного свинца. Образовавшийся сплав (свинец + натрий) переходит во второе отделение, где он становится анодом при электролизе расплавленного NaOH, а на катоде выделяется натрий. [c.326]
Следует отметить, что в перспективе на предприятии предусматривается ввод в эксплуатацию цеха электролиза поваренной соли. В качестве побочного продукта в этом процессе будет получаться водород, использование которого для получения аэросила позволит без дополнительных ка1Шталовложений снизить себестоимость аэросила на 177,25 руб1т, избежав при этом осложнения, связанного с ухудшением качества раствора гипохлорита натрия. [c.118]
chem21.info
Гипохлорит натрия, производство раствора гипохлорита натрия, электролиз, хранение, дозирование гипохлорита в электролизных установках, цены.
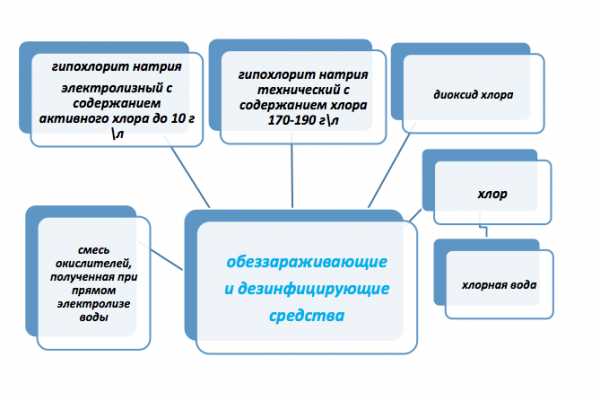
Основным действующим веществом в гипохлорите натрия (хлорной воде, анолите) является хлорноватистая кислота (НСLO), ион гипохлорита мало активен. Количество хлорноватистой кислоты в растворе дезинфектанта зависит как от указанного % — содержания активного хлора, так и от pH самого раствора:
в кислой и нейтральной среде доля хлорноватистой кислоты, HСlO, составляет 78%, а гипохлорита — 22%,
в щелочной среде, даже при рН=8, доля хлорноватистой кислоты, HСlO, всего- 24%, гипохлорита — 76%.
Технический гипохлорит натрия марки А и В по ГОСТ 11086-76*, получаемый хлорированием водного раствора едкого натра, имеет сильно щелочную среду (массовая концентрация щелочи от 10 до 60 г\л в зависимости от марки). Электролизный гипохлорит натрия выпускается по ТУ производителя. Содержание щелочи в нем не нормируется, зависит от технологии получения. Если производить гипохлорит натрия в электролизерах с анодами из оксидов рутения (ОРТА) или иридия (ОИРТА), которые выпускают почти все российские производители, то он будет иметь щелочную среду (РH 8-12). Как следствие такие гипохлориты имеют невысокие обеззараживающие свойства по сравнению с хлором (хлорной водой, анолитом), расход их на обеззараживание и окисление больше.
Специалисты НПФ РУТТЕХ задались целью получить электролизный гипохлорит с низким содержанием щелочи. Для чего были изготовлены аноды с покрытием из разных металлов платиновой группы и их смесей. Проведенные опыты показали, что на анодах ОРТА и ОИРТА из солевого раствора с содержанием NaCl 25-30 г\л можно получить гипохлорит, содержащий только 8 г\л хлора, а с анодами из смешанных оксидов платиновой группы можно получить те же 8 г\л хлора из солевого раствора, содержащего лишь 15 г\л NaCl. Так как расходуется меньше NaCl, то соответственно вырабатывается и меньше щелочи. В бездиафрагменном электролизере смешиваются кислый раствор, образованный у анода и щелочной раствор, образованный у катода. В результате образовался практически нейтральный раствор гипохлорита натрия.
Так с 2013 года НПФ РУТТЕХ стала выпускать принципиально новые электролизеры серии УЭ ГПХН Сэ с покрытием из смешанных оксидов платиновой группы, которые преобразуют практически всю соль в исходном растворе в хлор, при этом полученный гипохлорит натрия имеет практически нейтральную среду, которая обеспечивает ему высокие окислительные и обеззараживающие свойства.
Производство гипохлорита натрия на установках серии УЭ ГПХН СЭ более экономично.
Если сравнивать с электролизерами с разделительными мембранами (диафрагмами), то гипохлоритные электролизеры УЭ ГПХН СЭ более дешевы, просты в аппаратном оформлении и эксплуатации, не требуют утилизации щелочи, ежегодной замены мембраны, требуют меньше затрат соли и электроэнергии на 1 кг эквивалента активного хлора. Размещение установок на объекте не требует проектной привязки.
Если сравнивать с гипохлоритными электролизерами на базе анодов ОРТА и ОИРТА, то при одной и той же цене на установки себестоимость производства гипохлорита ниже по соли и электроэнергии практически в 1,5 раза.
Физико-химические свойства гипохлорита натрия марки Э,
полученного на установках серии УЭ ГПХН Сэ
| Наименование показателя | Норма | |
| 1 | Химическая формула | NaOCl |
| 2 | Метод получения | Электролиз раствора поваренной соли в бездиафрагменном электролизере |
| 3 | Состав | Хлорноватистая кислота, гипохлорит натрия, перекись водорода, хлор, диоксид хлора |
| 4 | Внешний вид | Бесцветная прозрачная или слегка зеленоватая жидкость |
| 5 | Запах | Хлора |
| 6 | Массовая концентрация активного хлора* | 8 г\л или 0,8% с возможностью доведения до 12 г\л |
| 7 | Массовая концентрация щелочи в пересчете на NaOH** |
Практически отсутствует |
| 8 | рH | Около 7 |
| 9 | Массовая концентрация соли NaCl | Практически отсутствует |
| 10 | Компоненты для производства |
Соль: 1,8-2 кг\кг акх |
| 11 | Себестоимость производства NaOCL | От 20 руб за кг эквивалента активного хлора |
| 12 | Срок хранения | 15 суток в темной стеклянной или полиэтиленовой посуде при температуре не выше 10 градС |
Примечание: Свойства по показателям по п.п. 7-12 отличаются
от свойств гипохлорита натрия, полученного с применением анодов ОРТА и ОИРТА.
*Массовая концентрация активного хлора в гипохлорите определяется:
- Поместите приблизительно 50 см3 дистиллированной воды в коническую колбу.
- Добавьте приблизительно 1 г кристаллов иодида калия.
- Добавьте 20 см3 уксусной кислоты (или приблизительно 10 г кристаллов лимонной кислоты)
- При помощи пипетки отберите 5 см3 конечного продукта УЭ ГПХН (как указано выше) и добавьте в колбу. [Раствор окрашивается в насыщенный красно-коричневый цвет в связи с высвобождением йода].
- Титрируйте раствором тиосульфата натрия 0,1 мол. дм– 3, постепенно добавляя его, пока цвет не исчезнет. По мере исчезновения цвета тиосульфат натрия следует добавлять осторожно, по каплям, чтобы точно определить конечную точку.
- Концентрация раствора, выраженная в эквиваленте хлора Cl2, определяется по следующей формуле: мг/л Cl2 = (Т × 3,456 × 1000)/ (Объем пробы), Где Т – титрирование в см3
**Массовая концентрация щелочи в гипохлорите определяется:
- 1000 см3 раствора гипохлорита, переносят пипеткой в коническую колбу и осторожно небольшими порциями прибавляют 20-25 см3 раствора перекиси водорода, осторожно перемешивая во избежание сильного газовыделения. Через 2-3 мин после прекращения интенсивного газовыделения в колбу прибавляют 2-3 капли фенолфталеина и титруют ее содержимое раствором соляной кислоты до обесцвечивания раствора.
- Обработка результатов: Массовую концентрацию щелочи в пересчете на NaOH (X1), г/дм3, вычисляют по формуле:
где V — объем раствора соляной кислоты концентрации точно 0,1 моль/дм3, израсходованный на титрование, см3;
0,004 — масса гидроокиси натрия, соответствующая 1 см3 раствора соляной кислоты концентрации точно 0,1 моль/дм3, г.
За результат анализа принимают среднее арифметическое результатов двух параллельных определений, абсолютное расхождение между которыми не превышает допускаемое расхождение, равное 0,5 г/дм3 при доверительной вероятности Р = 0,95.
- Допускаемая абсолютная суммарная погрешность результатов определения ±0,4 г/дм3 при доверительной вероятности Р = 0,95.
Требования безопасности
- Гипохлорит натрия является окислителем, вызывающим раздражение кожных покровов и слизистой оболочки. Гипохлорит натрия при попадании на кожу может вызвать ожоги, а при попадании в глаза — слепоту. При нагревании выше 35°С гипохлорит натрия разлагается с образованием хлоратов и выделением кислорода.
- Гипохлорит натрия негорюч и невзрывоопасен. Однако при контакте с органическими горючими веществами (опилки, ветошь и др.) в процессе высыхания может вызвать их загорание.
- Производственные помещения должны быть оборудованы приточно-вытяжной вентиляцией. Оборудование должно быть герметичным. Негерметичные узлы оборудования должны быть снабжены местными вентиляционными отсосами.
- Производственный персонал должен быть обеспечен специальной одеждой и иметь индивидуальные средства защиты: защитные очки, резиновые сапоги, резиновые перчатки, фартук из прорезиненной ткани и противогаз марки В или ВКФ (ГОСТ 12.4.121-83).
- Гипохлорит натрия не допускается хранить вместе с органическими продуктами, горючими материалами и кислотами.
- При попадании гипохлорита натрия на кожные покровы необходимо обмывать их обильной струей воды в течение 10-12 мин. При попадании брызг продукта в глаза следует немедленно промыть их обильным количеством воды и направить пострадавшего к врачу.
- В случае загорания — тушить водой, песком, углекислотными огнетушителями.
- Разлившийся гипохлорит натрия смыть водой.
Принцип обеззараживания электролизным гипохлоритом натрия
Раствор электролизного гипохлорита натрия смешивают с дезинфицируемой водой в требуемых пропорциях в зависимости от вида обрабатываемых вод и их хлорпоглощаемости. Продолжительность контакта хлора или гипохлорита с водой от момента смешения до поступления воды к ближайшему потребителю следует принимать в соответствии с ГОСТ 2874-82. Контакт хлорсодержащих реагентов с водой надлежит осуществлять в резервуарах чистой воды или специальных контактных резервуарах. При отсутствии попутного водоразбора допускается учитывать продолжительность контакта в водоводах.
Если Вы ранее использовали хлор для обеззараживания воды\стоков, то Вам потребуется то же количество эквивалента хлора в электролизном гипохлорите натрия, произведенного установками УЭ ГПХН СЭ,
Если же Вы ранее использовали технический гипохлорит натрия, то Вам потребуется в 1, 5 раза меньше эквивалента хлора в электролизном гипохлотире натрия, произведенного установками УЭ ГПХН СЭ (уточняется после запуска оборудования на объекте).
Свойства электролизного гипохлорита натрия
- Обладает высокой антимикробной активностью в отношении практически всех патогенных микроорганизмов.
- Обладает последействием.
- Разрушает фенолы – источник неприятного вкуса и запаха.
- Окисляет железо, марганец, сероводород, разрушает сульфид водорода, цианиды, аммиак и другие соединения азота.
- Способствует удалению мутности из воды.
- Удаляет биопленки.
- При содержаниях хлора в гипохлорите до 450 мг\л не образует побочных эффектов хлорирования.
- Уменьшает скорость коррозии водоводов.
- Имеет низкую себестоимость производства.
- Разрешен к применению для обеззараживания воды, стоков, оборотных вод, бассейнов, дельфинариев и пр.
www.rutteh.ru
электролизная установка для получения гипохлорита натрия — патент РФ 2349682
Изобретение может быть использовано для обработки бытовых и промышленных сточных вод. Установка для получения гипохлорита натрия включает не менее двух проточных электролизеров, в корпусе которых размещены по несколько электролитических ячеек, электродный модуль, состоящий из монополярных и биполярных пластинчатых электродов, узел подачи воды на разбавление поваренной соли и емкость приготовления раствора поваренной соли, которая соединена с насосом-дозатором подачи раствора поваренной соли в первый электролизер, выход которого соединен с входом второго электролизера. Выход второго электролизера соединен с входом последующего электролизера, а выход последнего электролизера соединен с резервуаром для хранения полученного гипохлорита натрия, который снабжен патрубком выброса водорода в атмосферу и патрубком для подачи гипохлорита натрия на обеззараживание воды. Узел подачи воды на разбавление дополнительно соединен с трубопроводом подачи исходного раствора поваренной соли в первый электролизер и с трубопроводом, установленным между выходом продуктов электролиза из первого электролизера и входом их во второй электролизер. Количество монополярных и биполярных электродов во втором электролизере больше, чем в первом, а расстояние между электродами, соответственно, меньше. Изобретение позволяет повысить надежность работы электролизеров, обеспечить оптимизацию электрического режима каждой электролитической ячейки. 2 ил. 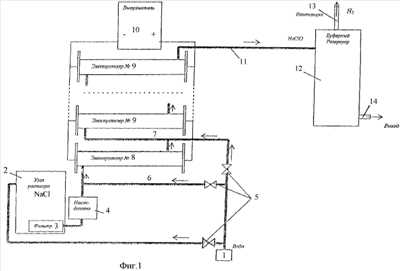
Рисунки к патенту РФ 2349682
Изобретение относится к электрохимии, а именно к электролитическим способам получения растворов гипохлоритов электролизом, и может быть использовано для обеззараживания воды и стоков.
Среди известных окислительных методов обработки воды ведущее место принадлежало хлорированию. Относительная доступность и дешевизна жидкого хлора обусловили его широкое использование в практике водоподготовки.
Однако технологические (достаточно сложная технология, специальные меры безопасности при транспортировке, хранении и применении и т.п.), экономические (содержание реагентного хозяйства и дополнительного штата обслуживающего персонала), экологические (токсичность хлора и высокая вероятность образования в процессе обработки воды токсичных, мутагенных и канцерогенных галогеносодержащих органических соединений) аспекты использования жидкого хлора стимулировали поиски более экономичного технического решения.
В настоящее время в качестве заменителя жидкого хлора используют хлорсодержащие реагенты, которые более безопасны и менее токсичны, чем жидкий хлор.
В последние десятилетия во всем мире все шире применяется раствор гипохлорита натрия NaClO, содержащий активный хлор, равноценный по своим дезинфицирующим и стерилизующим качествам чистому хлору. Его применение практически снимает все опасные и вредные производственные факторы, присущие использованию жидкого и газообразного хлора — сильнодействующего ядовитого вещества.
При этом раствор гипохлорита натрия, получаемый электрохимическим методом (марка Э по ТУ 6-01-29-93), является наиболее чистым и малотоксичным продуктом (класс опасности — 4 по ГОСТ 12.1.007-76) и имеет самую высокую эффективность обеззараживания.
Достоинства электролитического гипохлорита натрия как эффективного бактерицидного агента, простота и надежность электролизных установок, а также заинтересованность потребителей в применении безопасного электрохимического метода обеззараживания воды привели к созданию большого числа самых разнообразных по своей конструкции электролизеров.
Технологические схемы электролизных установок, работающих на растворах поваренной соли, могут быть как проточные, так и периодические с системой рециркуляции.
Основное отличие режимных параметров проточных электролизеров от параметров электролизеров периодического действия заключается в том, что в первом случае процесс электролиза можно полагать стационарным, не зависящим от времени. При этом если расход рассола, подаваемого на электролиз, и токовая нагрузка на электролизер остаются постоянными, то сохраняется неизменной и концентрация раствора гипохлорита натрия, отводимого из электролизера.
В электролизерах периодического действия концентрация гипохлорита натрия зависит от времени, прошедшего с начала электролиза.
В случае применения электролизеров периодического действия обслуживающий персонал должен значительно больше затрачивать времени на организацию процесса в связи с тем, что он вынужден несколько раз в сутки заполнять систему рециркуляции раствором и сливать из них гипохлорит натрия.
Известна установка для получения гипохлорита натрия, в которой минерализованная подземная вода, содержащая хлорид натрия, из скважины 1 подается по трубопроводу 2 в распределительный резервуар 3. Из резервуара 3 минерализированная вода самотеком поступает на проточный электролизер 4. Заданный расход минерализованной воды, подаваемый на проточный электролизер 4, устанавливается задвижками 5 и контролируется расходомером 6. Проточный электролизер 4 содержит емкость 10 с расположенными на противоположных ее стенках входным и выходным патрубками 11 и 12 соответственно. В емкости 10 установлены перпендикулярно потоку хлорида натрия и параллельно друг другу электродные кассеты 13, каждая из которых состоит из группы вертикальных пластинчатых электродов 14. Пластинчатые электроды 14 включены по биполярной схеме с токоподводом на крайние электроды 14 каждой электродной кассеты 13. Электродные кассеты 13 включены параллельно на общий стабилизированный пульт электропитания 15.
В электролизере 4 происходит электролитическое разложение водного раствора хлорида натрия, следствием которого является образование гипохлорита натрия и выделение водорода. Раствор гипохлорита натрия заданной концентрации из проточного электролизера 4 самотеком поступает в буферный резервуар 7, откуда насосом 8 подается в накопительный резервуар 9. Из резервуара 9 раствор гипохлорита натрия самотеком поступает к точкам ввода на обеззараживание воды. (Патент РФ №2100483).
Основным недостатком этой электролизной установки является ограниченность ее применения, т.к. она предназначена для получения гипохлорита натрия из слабоконцентрированых растворов, содержащих 1,5-8,0 г/л хлорида натрия, поэтому не может использоваться для электролиза концентрированных растворов поваренной соли.
В случае раствора из водного раствора поваренной соли, исходный раствор должен содержать не менее 30-40 г/л хлорида натрия, и, для увеличения выхода хлора, применяют каскадное включение электролизеров.
Известна электролизная установка «Sea clor» фирмы «De Nora» для получения гипохлорита натрия из поваренной соли. В баке для растворения соли готовят концентрированный рассол, который затем разбавляется до заданной концентрации 25-30 г/л в промежуточном баке. Раствор насосом-дозатором через сетчатый фильтр подается в электролизер или последовательно в ряд электролизеров. Полученный в результате электролиза гипохлорит натрия собирается в баке-хранилище. Электролизные газы удаляются после каждого электролизера в газоотделитель, а затем в атмосферу. Гипохлорит натрия в обрабатываемую воду подается насосом-дозатором.
Электропитание электролизеров осуществляется от выпрямительного агрегата.
Установка снабжена элементами автоматики, отключающими выпрямительный агрегат при нарушении технологического режима работы установки. Периодически, по мере зарастания катодов отложениями солей жесткости, электролизер промывается с помощью замкнутого кислотного контура. (Г.Л.Медриш и др. Обеззараживание природных и сточных вод с использованием электролиза. М.: Стройиздат. 1982, с.31).
Содержание активного хлора в готовом продукте 5-6 г/л. Более высокие концентрации хлора (до 8 г/л) могут быть достигнуты частичной рециркуляцией раствора, что увеличивает расход электроэнергии.
Для повышения выхода жидкофазного целевого раствора, получаемого электролизом исходного солевого раствора, после первой стадии электролиза исходного сильноконцентрированного раствора соли, включают последующий электролиз полученного на предыдущей стадии раствора при разбавлении его водой (патент РФ №2125120).
Реализация этого способа приведена в патенте РФ №2134733.
Сущность устройства заключается в том, что оно содержит корпус с установленными в нем параллельными электродами, помещенными между двумя перегородками, расположенными вдоль ряда параллельных электродов, крайние из которых соединены с токоподводами и являются монополярными, а промежуточные являются биполярными. Электроды разделяют корпус на последовательно сообщающиеся друг с другом первичную камеру, электролизную камеру и камеру сбора готового продукта, а также приспособление для подвода в корпус исходного раствора электролита и отверстие в корпусе для слива готового продукта, при этом перегородка, отделяющая первичную камеру от электролизной камеры, выполнена в нижней части перфорированной, перегородка, отделяющая электролизную камеру от камеры сбора готового продукта, выполнена с переливным отверстием в нижней части, к которому присоединена сливная труба, установленная вертикально в камере сбора готового продукта и выполненная открытой на верхнем конце, приспособление для подвода электролита установлено в верхней части электролизной камеры, а первичная камера снабжена расположенным в ее верхней части приспособлением для подвода воды.
По мнению автора изобретения за счет встречного потока жидкости скорость движения газовых пузырьков относительно поверхности электродов снижается, что способствует более равномерному протеканию электролиза в объеме электролита, сохранению приэлектродных ионных слоев, а также обеспечивает время контактирования пузырьков газа друг с другом, достаточное для их укрупнения. В результате снижается экранирование электродов газовыми пузырьками. Перечисленные факторы способствуют повышению эффективности протекания электролиза и увеличению выхода готового продукта.
Однако учитывая то, что вода, поступающая в первую камеру на разбавление электролита, играет роль гидрозатвора, попадание газовых пузырьков в нее проблематично. Конструкция установки для поддержания режима работы каждой камеры, требует определенного соотношение потоков: воды на разбавление и электролита, массы электролита и массы раствора в сливной трубе и т.д. Все эти факторы влияют на выход гипохлорита натрия и концентрацию активного хлора в нем, что усложняет эксплуатацию установки.
Наиболее близким техническим решением к предлагаемому является установка OSEC для производства гипохлорита натрия фирмы «WALLACE & TIERNAN».
Электролизная установка защищена патентом Великобритании №2068016А с приоритетом от 01 июля 1980 г (по дате поступления конвенционной заявки в патентное ведомство Англии), но само изобретение создано в США, защищено патентом США №4248690 с приоритетом 28 июня 1980 г., опубликовано 03 февраля 1981 г.
Электролизная установка включает четыре последовательно соединенных электролизера, состоящих из нескольких электродных ячеек (предположительно трех).
В первую ячейку вводят исходный раствор соли, а во вторую и третью камеру через патрубки вводят на разбавление воду в равном объеме, причем процесс электролиза в последнем электролизере заканчивают при десятикратном разбавлении исходного раствора соли, который содержит 26,4 вес.% хлорида натрия (примерно 300 г/л), т.е. разбавление водой в последнем электролизере составляет 1:10 (30 г/л хлорида натрия). Подача воды на разбавление концентрированного рассола поваренной соли и продуктов электролиза осуществляется через умягчитель воды. После растворения концентрированного рассола до исходной концентрации в сатураторе раствор через насос-дозатор рассола подается в первую электролитическую ячейку первого электролизера. Полученный гипохлорит натрия с выхода последнего (четвертого) электролизера поступает в резервуар для хранения его, который снабжен патрубком для выброса водорода с помощью воздуходувки в атмосферу и патрубком подачи гипохлорита натрия через насос-дозатор на обеззараживание воды.
Отвод водорода от каждого электролизера осуществляется отдельно и через коллектор водорода вводится в магистраль готового гипохлорита натрия.
Электропитание каждого электролизера осуществляется от выпрямителя. Работой установки управляет система автоматики.
Расход соли на 1 кг хлорного эквивалента составляет 3,0-3,9 кг в зависимости от разбавления водой, качества соли и температуры.
К недостаткам известного технического решения следует отнести:
— сложность обеспечения герметичности электролизеров из-за наличия в корпусе штуцеров для подвода воды на разбавление и отвода газообразных продуктов электролиза;
— повышенный расход электроэнергии, т.к. по мере снижения концентрации электролита необходимо менять электрический режим или конструкцию электродного узла электролизеров, а это в данном изобретении не осуществляют.
Технической задачей, решаемой предлагаемым изобретением, является устранение вышеуказанных недостатков, чтобы повысить надежность работы электролизеров и сохранить величину потенциала электролитических ячеек постоянным в течение всех стадий электролиза.
Технический результат достигается за счет того, что в известную электролизную установку для производства гипохлорита натрия, включающую несколько, не менее двух, проточных электролизеров, в корпусе которых размещены по несколько электролитических ячеек с электродным модулем, состоящим из монополярных, соединенных с источником электропитания, и биполярных пластинчатых электродов, установленных параллельно на определенном расстоянии друг от друга, узел подачи воды на разбавление поваренной соли, находящейся в емкости, и на разбавление продуктов электролиза в процессе его осуществления, емкость приготовления раствора поваренной соли соединена с насосом-дозатором подачи раствора поваренной соли в первый электролизер, выход которого соединен с входом второго электролизера, выход второго электролизера соединен с входом последующего электролизера, а выход последнего электролизера — с резервуаром для хранения полученного гипохлорита натрия, причем резервуар снабжен патрубком выброса водорода в атмосферу и патрубком для подачи гипохлорита натрия на обеззараживание воды, внесены изменения и дополнения, а именно:
— узел подачи воды на разбавление дополнительно соединен с трубопроводом подачи исходного раствора поваренной соли в первый электролизер;
— и с трубопроводом между выходом продуктов электролиза из первого электролизера и входом их во второй электролизер;
— количество монополярных и биполярных электродов во втором электролизере больше, чем в первом;
— расстояние между монополярными и биполярными электродами во втором электролизере соответственно меньше, чем в первом электролизере;
— конструкция электролизеров, входящих в установку, начиная со второго электролизера, аналогична.
Введение предварительного разбавления раствора поваренной соли до 100-120 г/л NaCl в трубопроводе исключает промежуточную емкость и позволяет оптимизировать электрический режим первого электролизера без дополнительного разбавления исходного раствора поваренной соли внутри первого электролизера.
Дополнительное разбавление электролита, содержащего продукты электролиза после первого электролизера, позволяет снизить концентрацию раствора до оптимальной (30-40 г/л), поэтому разбавление электролита после второго электролизера не требуется.
Повышение надежности работы электролизеров достигается исключением штуцеров для подвода воды и отвода газообразных продуктов электролиза, которые вместе с электролитом транзитом поступают в резервуар для хранения гипохлорита натрия.
Обратно пропорциональная зависимость суммарной площади электродов и плотности тока первого и последующих электролизеров позволяет поддерживать постоянный потенциал на всех электролитических ячейках электролизеров и уменьшить расход электроэнергии, повысив КПД установки на 15%.
Идентичность конструкции второго и последующих электролизеров облегчает их изготовление и замену, а также позволяет резервировать количество электролизеров в установке, т.к. на основании опытных данных было установлено, что наилучшие результаты по выходу активного хлора достигаются при 4-6 электролизеров.
На фиг.1 изображена технологическая схема обработки воды гипохлоритом натрия; на фиг.2 — проточный электролизер для получения гипохлорита натрия из раствора поваренной соли.
На фиг.1 показан узел 1 подачи воды на разбавление концентрированного рассола поваренной соли, находящегося в емкости 2, фильтр 3, насос-дозатор 4, управляемые вентили 5, установленные на дополнительных трубопроводах 6 и 7, электролизеры 8, 9, причем все последующие электроды имеют обозначение 9, т.к. их конструкция одинакова. Электропитание электролизеров осуществляется от выпрямителя 10. Выход последнего электролизера соединен трубопроводом 11 с буферной емкостью 12 для хранения готового гипохлорита натрия. Буферная емкость снабжена патрубком 13 для выброса газообразных продуктов электролиза (водорода) и патрубком 14 для подачи гипохлорита натрия на обеззараживание воды.
Из фиг.2 видно, что проточный электрод состоит из корпуса 15, имеющего патрубки 16, 17 для ввода исходного раствора поваренной соли и вывода продуктов электролиза соответственно. Внутри корпуса размещены электролитические ячейки 18 (на фиг.2 показано четыре, но может быть и больше), электродный модуль 19, образованный пластинчатыми, расположенными параллельно монополярными электродами 20 и биполярными 21, причем монополярные электроды соединены с соответствующим полюсом выпрямителя 10, образуя анод и катод. Между электродами находятся изоляционные прокладки 22, а электроды каждой электролитической ячейки крепятся стяжками 23.
Работает установка следующим образом.
Вода из узла 1 подачи ее на растворение поваренной соли поступает в емкость 2, в которой находится концентрированный рассол поваренной соли. Раствор поваренной соли через фильтр 2 насосом дозатором 3 подается в магистраль подачи его в первый электролизер 1. В эту же магистраль от узла разбавления 1 посредством трубопровода 6 поступает вода на разбавление исходного раствора поваренной соли до 100-120 г/л. Расход воды регулируется вентилем 5 и контролируется расходомером (на фиг.1 не показан). В первом электролизере 8 и последующих электролизерах 9 происходит электролиз раствора поваренной соли или продуктов предыдущего электролиза. Все электролизеры являются проточными и состоят из корпуса 15, имеющего входной патрубок 16, через который поступает с заданной концентрацией раствор поваренной соли, а в электролизерах 9 продукты предыдущего электролиза. В корпусе 15 размещены четыре электролитические ячейки 18 и электродный узел 19, включающий монополярные 20 и биполярные 21 пластинчатые электроды, расположенные параллельно на определенном расстоянии.
Монополярные 20 электроды соединены с выпрямителем 10, образуя анод (+) и катод (-). На биполярных 21 электродах, за счет протекания электролита между ними, также образуются аноды и катоды. При пропускании электрического тока через растворы электролитов протекают окислительно-восстановительные реакции.
В данном случае, когда в качестве электролита используется раствор поваренной соли, сущность процесса заключается в следующем.
На аноде идет разряд ионов хлора (процесс окисления): 2Cl-=Cl 2+2е-.
Выделяющийся хлор растворяется в электролите (NaCl) c образованием хлорноватистой и соляной кислот: Cl 2+Н2O=HClO+HCl.
На катоде происходит разряд молекул воды (процесс восстановления): Н 2O+е-=ОН-+Н+.
Атомы водорода после рекомбинации выделяются из раствора в виде газа, оставшиеся же в растворе ионы ОН- образуют возле катода с ионами Na+ щелочь.
Вследствие перемешивания анолита с католитом происходит взаимодействие хлорноватистой кислоты со щелочью с образованием гипохлорита натрия: HClO+NaOH=NaClO+Н 2O.
Если все количество щелочи, образующееся на катоде, будет поступать к аноду, то процесс электролиза протекает только с образованием раствора гипохлорита натрия.
Получающийся гипохлорит натрия в значительной степени диссоциирует с образованием ионов ClO-, которые способны к дальнейшему анодному окислению с образованием хлорат-иона ClO3-:
6ClO-+6OН- -6е-=6Н2O+4Cl-+2ClO 3-+1,5O2.
Концентрация ионов ClO- существенно влияет на дальнейший ход электролиза. Ионы ClO- разряжаются при значительно меньших потенциалах анода, чем ионы Cl-, поэтому уже при незначительных концентрациях гипохлорита натрия на аноде начинается совместный разряд ионов Cl- и ClO-.
Получаемый раствор гипохлорита натрия достаточно стоек и может длительное время храниться без значительного разложения при соблюдении определенных условий.
Полученные в первом электролизере 8 продукты электролиза через выходной патрубок 17 поступает в трубопровод 7, соединенный с узлом разбавления 1. В нем продукты предыдущего электролиза разбавляются примерно в три раза, так что концентрация хлоридов в них находится на уровне 30 г/л и поступает во второй электролизер 9, а из него продукты реакции поступают в третий электролизер и т.д.
Соответственно, плотность тока в первом электролизере 8 может поддерживаться в диапазоне 500-900 А/м2, а в последующих электролизерах 9, примерно, в два раза меньше, т.е. 300-500 А/м 2. Достигается это изменением количества монополярных и биполярных электродов таким образом, что суммарная площадь электродов пропорциональна плотности тока в них, т.е.
Гипохлорит натрия вместе с газообразными продуктами по магистрали 11 поступают в буферную емкость 12 для хранения гипохлорита натрия. С помощью воздуходувки (на фиг.1 не показана) через патрубок 13 водород отделяется от гипохлорита натрия и выбрасывается в атмосферу.
Гипохлорит натрия через патрубок 14 направляют на обеззараживание воды.
Преимущества предлагаемого изобретения заключаются:
— в повышении надежности работы электролизеров за счет исключения их разгерметизации;
— сохраняется постоянство напряжения на всех электролитических ячейках электролизерного узла;
— оптимизация электрического режима;
— повышение извлечения хлоридов их исходного раствора поваренной соли.
В настоящее время изготавливаются отдельные элементы электролизной установки и в конце этого или начале следующего года она будет сдана в эксплуатацию.
ФОРМУЛА ИЗОБРЕТЕНИЯ
Электролизная установка для производства гипохлорита натрия, включающая не менее двух проточных электролизеров, в корпусе которых размещены по несколько электролитических ячеек, электродный модуль, состоящий из монополярных, соединенных с источником электропитания, и биполярных пластинчатых электродов, установленных параллельно на определенном расстоянии друг от друга, узел подачи воды на разбавление поваренной соли, находящейся в емкости приготовления раствора поваренной соли, которая соединена с насосом-дозатором подачи раствора поваренной соли в первый электролизер, выход которого соединен с входом второго электролизера, выход второго электролизера соединен с входом последующего электролизера, а выход последнего электролизера соединен с резервуаром для хранения полученного гипохлорита натрия, который снабжен патрубком выброса водорода в атмосферу и патрубком для подачи гипохлорита натрия на обеззараживание воды, отличающаяся тем, что узел подачи воды на разбавление дополнительно соединен с трубопроводом подачи исходного раствора поваренной соли в первый электролизер и с трубопроводом, установленным между выходом продуктов электролиза из первого электролизера и входом их во второй электролизер, причем количество монополярных и биполярных электродов во втором электролизере больше, чем в первом, а расстояние между электродами соответственно меньше.
www.freepatent.ru
Электролиз водного раствора солей
Хлорирование
Применение гипохлорита натрия (NaClO) обусловлено его химической способностью к нейтрализации целого ряда вредных микроорганизмов. Его бактерицидные свойства направлены на уничтожение целого ряда опасных грибков и бактерий.
Чтобы получить гипохлорит натрия необходимо провести процесс хлорирования едкого натра (NaOH) с помощью молекулярного хлора (Cl).
Принцип действия гипохлорита натрия (NaClO) достаточно простой, так как это вещество имеет высокие биоцидные (биоцид – химические средства, предназначенные для борьбы с вредными или болезнетворными микроорганизмами) свойства. Когда гипохлорит натрия (NaClO) попадает в воду, он начинает активно разлагаться, образовывая при этом активные частицы в виде радикалов и кислорода.Радикалы гипохлорита натрия (NaClO) направлены против вредных микроорганизмов. Активные частицы гипохлорита натрия (NaClO) начинают разрушать внешнюю оболочку или биопленку микроорганизма, таким образом, это приводит к окончательной гибели различных патогенных грибков, вирусов и бактерий.Химический состав гипохлорита натрия направлен на обеззараживание и дезинфекцию воды. Поэтому это вещество занимает важное место во многих сферах человеческой жизни. Мировые исследования показывают, что гипохлорит натрия (NaClO) для дезинфекции применяют в 91% случаев, остальные 9% включают гипохлорит калия или лития. Но чтобы это вещество дало результат и пользу в быту, необходимо внимательно следить за концентрацией раствора.
Хлорирование оказалось самым простым и дешевым способом обеззараживания воды, поэтому быстро распространилось по миру. Сейчас можно сказать, что традиционным методом обеззараживания питьевой воды, принятым во всем мире (в 99 случаев из 100), является именно хлорирование, и сегодня для хлорирования воды ежегодно расходуют сотни тысяч тонн хлора.Например, в России хлорированию подвергается более 99% воды и для этих целей используют в среднем в год около 100 тыс. тонн хлора.
В существующей практике обеззараживания питьевой воды хлорирование используется наиболее часто как наиболее экономичный и эффективный метод в сравнении с любыми другими известными методами, поскольку это единственный способ, обеспечивающий микробиологическую безопасность воды в любой точке распределительной сети в любой момент времени благодаря эффекту последействия хлора.
Хорошо известно, что хлор (Cl), реагируя с водой, образует не «хлорную воду» (как считалось ранее), а хлорноватистую кислоту (HClO) – первое вещество, полученное химиками, которое содержало активный хлор.
Из уравнения реакции:HClO + HCl ↔ Cl2 + H2O, следует, что теоретически из 52,5 г. чистой HClO можно получить 71 г Cl2, то есть хлорноватистая кислота содержит 135,2% активного хлора. Но эта кислота неустойчива: максимально возможная ее концентрация в растворе – не более 30%.
Хлор легко растворяется в воде, убивая в ней все живое. Как было установлено после смешения газообразного хлора с водой в водном растворе устанавливается равновесие:
Cl2 + H2O ↔ HClO + HCl
Далее происходит диссоциация (диссоциация это распад частицы(молекулы, радикала, иона), на несколько более простых частиц) образовавшейся хлорноватистой кислоты НОСl ↔ Н+ + ОСl –
Наличие хлорноватистой кислоты в водных растворах хлора и получающиеся в результате ее диссоциации анионыОСl – обладают сильными бактерицидными свойствами (это способность уничтожать микроорганизмы). При этом выяснилось, что свободная хлорноватистая кислота почти в 300 раз более активна, чем гипохлорит-ионы ClO –. Объясняется это уникальной способностью HClO проникать в бактерии через их мембраны. Кроме того, как мы уже указывали, хлорноватистая кислота подвержена разложению на свету:
2HClO → 2 1O2 + 2HCl → О2 + HCl
с образованием хлористоводородной кислоты и атомарного (синглетного) кислорода (в качестве промежуточного вещества), который является сильнейшим окислителем.
Процесс хлорирования.
На станции водоподготовки хлор поставляется в сжиженном состоянии в специализированных контейнерах различной вместимостью, баллонах малого и среднего объема. Но для обеззараживания воды применяется хлор в газообразном состоянии. Газообразный хлор получают из жидкого путем его испарения в змеевиковых испарителях, представляющих собой вертикальные цилиндрические аппараты с размещенными внутри змеевиками, по которым проходит жидкий хлор. Дозирование полученного газообразного хлора в воду производится через специальные устройства – вакуумные хлораторы.
После введения хлора в обрабатываемую воду должны быть обеспечено хорошее смешение его с водой и достаточная продолжительность его контакта с водой (не менее 30 мин) до подачи воды потребителю. Следует отметить, что вода перед хлорированием должна быть уже подготовленной и, как правило, хлорирование обычно производят перед поступлением осветленной воды в резервуар чистой воды, где и обеспечивается необходимое время контакта.
Основными преимуществами применения для обеззараживания воды газообразным хлором
являются:
- низкая себестоимость процесса обеззараживания воды;
- простота проведения процесса хлорирования;
- высокая дезинфицирующая способность газообразного хлора;
- хлор воздействует не только на микроорганизмы, но и окисляет органические и неорганические вещества;
- хлор устраняет привкусы и запахи воды, ее цветность, не способствует увеличению мутности.
Однако хлор является сильно действующим ядовитым веществом, относящимся ко второму классу опасности.Газообразный хлор – сильный окислитель, поддерживает горение многих органических веществ, пожароопасен при контакте с горючими веществами. Скипидар, титан и порошки металлов в атмосфере хлора способны самовозгораться при комнатной температуре. С водородом хлор образует взрывоопасные смеси.
Подчас затраты на обеспечение безопасности при хлорировании превосходят затраты на собственно хлорирование воды.
В этом плане применение гипохлорита натрия в качестве хлор агента при хлорировании воды является хорошей альтернативой газообразному хлору.
Электролиз
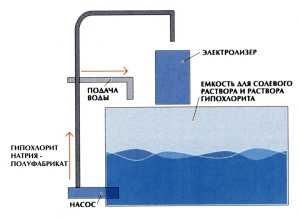
Наиболее дешевым, простым и безопасным является способ получения дезинфицирующих растворов гипохлорита натрия путем электролиза водного раствора хлорида натрия (NaCl) и его взаимодействия со щелочью в одном и том же аппарате – электролизере.

На фотографиях показан электролизёр. Насос дозатор Seko для дозирования гипохлорита натрия и герметичный насос Argal для перекачивания рассола NaCl
Сохраняя все достоинства метода хлорирования с применением жидкого хлора, обеззараживание электролитическим гипохлоритом натрия позволяет избежать основных трудностей транспортирования и хранения токсичного газа.
Использование низко концентрированных растворов гипохлорита натрия повышает безопасность производственного процесса обеззараживания воды по сравнению с жидким хлором и высококонцентрированным раствором гипохлорита натрия.
Сырьем для производства гипохлорита натрия служит поваренная соль. Поскольку реагент используется непосредственно на месте получения, отпадает необходимость транспортировки.
Технологический процесс производства гипохлорита натрия включает следующие операции:
- Приготовление насыщенного раствора поваренной соли.
- Основной процесс получения гипохлорита натрия электролизом.
При электролизе раствора хлорида натрия происходят следующие реакции:
на катоде: 2Na+ + 2е→2Na;
2Na + 2h3O→2NaOH (гидроксид натрия) + H2↑;
на аноде: 2Cl — – 2е→Cl2;
Cl2 + 2H2O →2HClO (хлорноватистая кислота) + HCl.
Суммарная реакция может быть представлена в виде:
NaCl + H2O→NaClO + H2↑.
Поскольку процесс окисления гипохлорита натрия с последующим образованием хлоритов и хлоратов замедляется при понижении температуры, электролиз проводят при относительно низких температурах рабочего раствора соли (20–25 С°).
В специальные емкости – сатураторы через загрузочное устройство засыпается соль. Сырьем для производства низкоконцентрированных растворов гипохлорита натрия служит пищевая поваренная соль высшего сорта или «Экстра». Залитая вода, проходя через солевой слой, образует насыщенный раствор поваренной соли.
Для очистки концентрированного раствора соли используются фильтры грубой очистки и сменные полипропиленовые картриджные фильтры тонкой очистки с пропускной способностью 5 мкм.
Насыщенный раствор поваренной соли насосом подается в смеситель, где происходит разбавление водопроводной водой до рабочей концентрации (по СанПиН 2.1.4.1074-01), и далее – в электролизёр.
Основной процесс получения гипохлорита натрия электролизом проводится в установках, состоящих из электролизной ванны и теплообменника. В теплообменниках летом охлаждают электролит (водопроводной водой), а зимой предварительно нагревают рабочий раствор соли.
В электролизных ваннах титановые электроды покрыты диоксидами рутения и иридия. В процессе электролиза на электродах происходит отложение кальция и магния, поэтому периодически, по мере образования этих отложений, производится промывка электролизеров в закрытом контуре 4-процентным раствором соляной кислоты (HCl).
В электролизере происходит непрерывный электролиз рабочего раствора соли, в результате чего получают гипохлорит натрия. Трехпроцентный раствор NaCl с постоянным объемным расходом 2,5 м3/ч протекает через установку электролиза до достижения желаемой концентрации NaClO (0,8%). Образующийся в электролизерах гипохлорит натрия хранится в специальных резервуарах, для обеспечения запаса для нужд очистных сооружений.
Гипохлорит натрия с концентрацией не менее 8 г/л по активному хлору поступает в резервуар накопитель, откуда насосами подается к узлам дозирования, расположенным вблизи точек ввода реагента. Из емкостей гипохлорит натрия по системе трубопроводов подаётся насосами дозаторами на автоматическую станцию дозирования в обрабатываемую воду.
Вывод
Использование низко концентрированных растворов гипохлорита натрия позволяет повысить безопасность технологических процессов очистки воды на водопроводных станциях.
Сочетание обеззараживания обрабатываемой воды низко концентрированным гипохлоритом натрия (первая ступень) с ультрафиолетовым облучением перед подачей в городскую водопроводную сеть (вторая ступень) гарантирует полное соответствие качества воды по микробиологическим показателям действующим нормативам и ее высокую эпидемиологическую безопасность.
tex-servis.ru
Получение — гипохлорит — натрий
Получение — гипохлорит — натрий
Cтраница 1
Получение гипохлорита натрия электролизом производят л периодическом или непрерывном режимах. [1]
Для получения гипохлорита натрия хлорированию подвергают раствор каустической соды. Для стабилизации активного хлора в отхлорированной массе оставляют 1 0 — 1 5 % свободной щелочи. Хлорирование ведут хлорвоздушной смесью ( 20 — 25 % хлора) при 20 — 27 С. [2]
Для получения гипохлорита натрия методом хлорирования едкой щелочи обычно применяют 20 — 30 % — ный раствор NaOH, что позволяет избежать выделения хлористого натрия в твердую фазу. Процесс осуществляют в башнях с непрерывной циркуляцией растворов или в бетонных резервуарах, снабженных змеевиками для охлаждения и мешалками для перемешивания. [3]
Процесс получения гипохлорита натрия электролизом разбавленных растворов хлоридов характеризуется жесткими условиями эксплуатации анодов ввиду того, что на них, помимо разряда ионов С1 -, происходит также выделение кислорода. В результате проведенных в последние годы исследований определено, что наиболее подходящими для данного процесса анодами, являются аноды, включающие титановую основу, на которую нанесено активное покрытие из металлов платиновой группы или из смеси оксидов металлов на основе оксидов рутения или других металлов этой группы. [5]
При получении гипохлорита натрия на месте потребления путем электролиза растворов хлоридов в качестве исходного рассола могут использоваться растворы обычной поваренной соли или природные электролиты — подземные минерализованные и морские воды. [7]
При получении гипохлорита натрия из морской воды, расход которой составляет 4 л на 1 м3 сточной воды, затрачивается 3 — 5 кВт — ч электроэнергии. [8]
Сырьем для получения гипохлорита натрия служит очищенный раствор поваренной соли. После электролиза гипохлоритные растворы сливают, а электролизеры снова заполняют свежей порцией исходного раствора. [9]
Электрохимический метод получения гипохлорита натрия наиболее эффективно применять при получении сравнительно разбавленных растворов, в случае установок небольшой мощности с использованием местного исходного сырья, например морской воды, природных рассолов или содержащих хлорид натрия стоков. [10]
Электрохимический способ получения гипохлорита натрия основан на получении хлора и его взаимодействии со щелочью в одном и том же аппарате — электролизере. [11]
Электрохимический метод получения гипохлорита натрия представляет собой одностадийный процесс окисления растворов поваренной соли в бездиафрагменных электролизерах. [12]
Электрохимический способ получения гипохлорита натрия основан на получении хлора и его взаимодействии со щелочью в одном и том же аппарате — электролизере. [14]
Основными условиями получения гипохлорита натрия с наилучшими показателями являются электролиз нейтрального концентрированного раствора хлорида натрия, низкая температура, отсутствие перемешивания электролита, высокая электродная плотность тока. [15]
Страницы: 1 2 3 4
www.ngpedia.ru
Гипохлорит натрия для обеззараживания питьевой воды
Главная » Услуги » Электролизный гипохлорит СЧИТАТЬ ПРАВИЛЬНЫМ ВСЯКОЕ
УТВЕРЖДЕНИЕ, ПОЛУЧЕННОЕ
ИЗ ОПЫТА С ПОМОЩЬЮ ИНДУКЦИИ,
ПОКА НЕ БУДУТ ОБНАРУЖЕНЫ
ДРУГИЕ ЯВЛЕНИЯ,
КОТОРЫЕ ОГРАНИЧИВАЮТ
ЭТО УТВЕРЖДЕНИЕ
ИЛИ ПРОТИВОРЕЧАТ ЕМУ.
Исаак Ньютон
Сегодня многие люди понимают необходимость ведения здорового образа жизни, стараются следить за своим здоровьем, весом и физическим тонусом. Однако, если не будет качественной и экологически безопасной воды, то все усилия могут оказаться слабо эффективными. Здесь не будет банальным воспользоваться популярным афоризмом «вода – это жизнь», однако как для ее очистки используется гипохлорит натрия, многим остается загадкой. Ассоциации со всем известной «хлоркой» напрашиваются, но их применение не совсем обоснованно.
Смысл процесса обеззараживания воды в дезинфекции этой важнейшей для существования человека жидкости, то есть, результатом должна стать бактериологически чистая вода, которую можно применять не только для промышленных, но и для домашних нужд. Наличие бактерий в любой среде – это не для кого ни секрет, то, что не все бактерии погибают при кипячении воды, тоже известно большинству людей, а вот как обезвредить наиболее опасных в данном случае бактерий из группы кишечной палочки и др.? Вот в этом и призван помочь гипохлорит натрия, который защитит от дизентерии и многих других болезней использованием в достаточно несложном и не затратном процессе. Процесс обеззараживания воды гипохлоритом натрия является наиболее эффективным по сравнению с озонированием, ультрафиолетовым облучением, серебрением или обработкой ультразвуком. Однако большие концентрации хлора являются токсичными и вредными не только человеку, но и всей окружающей среде.
Для того, чтобы применение хлорных составов не вызывало осложнений из-за передозировок, не требовалось сложных конструкций химических дозаторов и не было необходимости в постоянных пробах и расчетах, стали применять натрия гипохлорит. Он получается при помощи электролизных установок, которые исключают возможности для неправильной дозировки и дают уверенность в правильности работы системы очистки. Обеззараженная таким образом вода абсолютно не токсична, хотя и натрия гипохлорит требует знаний по его правильному применению, риск здесь минимален. Эффект действия описываемого вещества основан на сильном окислении, которое дает максимальное бактерицидное, туберкулоцидное и вирулицидное влияние на воду. При этом электролизный гипохлорит натрия имеет главное отличие от жидкого хлора – он не токсичен, именно поэтому сейчас многие регионы обращаются именно к этой методике обеззараживания.
Технология получения гипохлорита натрия электролизом солевых растворов для обеззараживания питьевых и сточных вод.
При традиционном способе электролиза раствора поваренной соли быстро достигается насыщение по концентрации активного хлора в гипохлорите практически независимо от концентрации соли в начальном растворе (рис. 1) :
рис.1
В практике электролиза, это обстоятельство определяет рабочую концентрацию солевого раствора на уровне 25-30г/л поваренной соли.
По закону М. Фарадея процесс электролиза должен идти иначе (рис.2):
рис.2
Если полученный гипохлорит разбавить водой и провести электролиз
разбавленного продукта, масса превращения соли в гипохлорит увеличивается пропорционально разбавлению (рис. 3), приближаясь к закону электролиза М. Фарадея.
рис.3
Наблюдаемый эффект позволяет начать процесс электролиза с высокой концентрации соли, что позволяет экономить энергию и наиболее эффективно вырабатывает соль. Научное значение полученного результата – уточнение второго закона термодинамики. В соответствии с этим законом устанавливается соотношение между химической работой и тепловой энергией ее сопровождающей. Экспоненциальная зависимость (рис.1) между массой превращенного вещества (химическая работа) и затратами тепловой энергии, когда химическая работа прекращалась, объясняется в соответствии со вторым законом термодинамики энтропийными процессами. Это объяснение вызывает сомнение в применимости второго закона термодинамики к полученным нами результатам: без дополнительных затрат энергии, а лишь за счет подачи воды на разбавление, нам удалось добиться перераспределения затрат энергии в пользу химической работы за счет уменьшения доли тепловой энергии. Это наблюдение открывает доступ к новым инновационным технологиям, получения альтернативной энергии, очистке вод различного назначения от дисперсных частиц.
Цена найденного технологического решения становится понятной, если учесть многочисленные попытки западных фирм, которые несмотря на репутационные потери ( отсутствие патентов и статей по данной технологии) претендовали на интеллектуальную собственность, заключенную в российском патенте №2125120 «Способ электролиза водного раствора соли» и его евразийском аналоге патенте №001666 (см.раздел «Репутация»).
Промышленная реализация новой технологии электролиза
www.npk-ekolog.ru
