Пероксид (перекись) водорода
Кроме воды, известно другое соединение водорода с кислородом — пероксид водорода (Н2 О2 ). В природе он образуется как побочный продукт при окислении многих веществ кислородом воздуха. Следы его постоянно содержатся в атмосферных осадках. Пероксид водорода частично образуется также в пламени горящего водорода, но при остывании продуктов сгорания разлагается.
В довольно больших концентрациях (до нескольких процентах) Н2 О2 может быть получена взаимодействием водорода в момент выделения с молекулярным кислородом. Пероксид водорода частично образуется также при нагревании до 2000 °С влажного кислорода, при прохождении тихого электрического разряда сквозь влажную смесь водорода с кислородом и при действии на воду ультрафиолетовых лучей или озона.
Теплота образование пероксида водорода.
Непосредственно определить теплоту образования пероксида водорода из элементов не удаётся. Возможность найти её косвенным путём даёт установленный Г. И. Гессом (1840 г.) закон постоянства сумм тепла: общий тепловой эффект ряда последовательных химических реакций равен тепловому эффекту любого другого ряда реакций с теми же самыми исходными веществами и конечными продуктами.
Строго говоря, закон Гесса следовало бы сформулировать, как «закон постоянства сумм энергий», потому что при химических превращениях энергия может выделяться или поглощаться не только в тепловой, но и как механическая, электрическая и др. Кроме того, предполагается, что рассматриваемые процессы протекают при постоянном давлении или постоянном объёме. Как правило, именно так и обстоит дело при химических реакциях, а все другие формы энергии могут быть пересчитаны на тепловую. Сущность этого закона особенно наглядно выявляется в свете следующей механической аналогии: общая работа, производимая опускающимся без трения грузом, зависит не от пути, а только от разности начальной и конечной высот. Подобным же образом общий тепловой эффект той или иной химической реакции определяется только разностью теплот образования (из элементов) её конечных продуктов и исходных веществ. Если всё эти величины известны, то для вычисления теплового эффекта реакции достаточно из суммы теплот образования конечных продуктов вычесть сумму теплот образования исходных веществ. Законом Гесса часто пользуются при вычислении теплот таких реакций, для которых прямое экспериментальное их определение трудно или даже невозможно.
В применении к Н2 О2 расчёт можно провести на основе рассмотрения двух различных путей образования воды:
1. Пусть первоначально при соединении водорода и кислорода образуется пероксид водорода, который затем разлагается на воду и кислород. Тогда будем иметь следующие два процесса:
2 Н2 + 2 О2 = 2 Н2 О2 + 2х кДж
2 Н2 О2 = 2 Н2 О + О2 + 196 кДж
Тепловой эффект последней реакции легко определяется экспериментально. Складывая почленно оба уравнения и сокращая одиночные члены, получаем
2 Н2 + О2 = 2 Н2 О + (2х + 196) кДж.
2. Пусть при соединении водорода с кислородом непосредственно образуется вода, тогда имеем
2 Н2 + О2 = 2 Н2 О + 573 кДж.
Так как в обоих случаях и исходные вещества, и конечные продукты одинаковы, 2х + 196 = 573, откуда х = 188,5 кДж. Это и будет теплота образования моля пероксида водорода из элементов.
Получение.
Пероксид водорода проще всего получать из пероксида бария (ВаО2), действуя на неё разбавленной серной кислотой:
ВаО2 + Н2 SO4 = BaSO4 + Н2 О2 .
При этом наряду с пероксидом водорода образуется нерастворимый в воде сульфат бария, от которого жидкость может быть отделена фильтрованием. Продаётся Н2О2 обычно в виде 3%-ного водного раствора.
Продолжительным упариванием обычного 3%-ного водного раствора Н2 О2 при 60-70 °С можно довести содержание в нём пероксида водорода до 30%. Для получения более крепких растворов отгонку воды приходится производить под уменьшенным давлением. Так, при 15 мм рт. ст. сначала (примерно с 30 °С) отгоняется главным образом вода, а когда температура достигает 50 °С, в перегонной колбе остаётся очень концентрированный раствор пероксида водорода, из которого при сильном охлаждении могут быть выделены его белые кристаллы.
Основным методом получения пероксида водорода является взаимодействие с водой надсерной кислоты (или некоторых её солей), легко протекающее по схеме:
Н2 S2 O8 + 2 H2 O = 2 H2 SO4 + Н2 О2 .
Меньшее значение имеют некоторые новые методы (разложение органических пероксидных соединений и др.) и старый способ получения из ВаО2
Физические свойства.
Чистый пероксид водорода — бесцветная сиропообразная жидкость (с плотностью около 1,5 г/мл), под достаточно уменьшенным давлением перегоняющуюся без разложения. Замерзание Н2 О2 сопровождается сжатием (в отличие от воды). Белые кристаллы пероксида водорода плавятся при -0,5 °С, т. е. почти при той же температуре, что и лёд.
Теплота плавления пероксида водорода составляет 13 кДж/моль, теплота испарения — 50 кДж/моль (при 25 °С). Под обычным давлением чистый Н2 О2 кипит при 152 °С с сильным разложением (причём пары могут быть взрывоопасны). Для его критических температуры и давления теоретически рассчитаны значения 458 °С и 214 атм. Плотность чистого Н2 О2 равна 1,71 г/см3 в твёрдом состоянии, 1,47 г/см3 при 0 °С и 1,44 г/см3 при 25 °С. Жидкий пероксид водорода, подобно воде, сильно ассоциирована. Показатель преломления Н 2 О2 (1,41), а также её вязкость и поверхностное натяжение несколько выше, чем у воды (при той же температуре).
Структурная формула.
Структурная формула пероксида водорода Н-О-О-Н показывает, что два атома кислорода непосредственно соединены друг с другом. Связь это непрочна и обусловливает неустойчивость молекулы. Действительно, чистая Н2 О2 способна разлагаться на воду и кислород со взрывом. В разбавленных водных растворах она значительно устойчивее.
Оптическими методами установлено, что молекула Н-О-О-Н не линейна: связи Н-О образуют углы около 95° со связью О-О. Крайними пространственными формами молекул подобного типа являются показанные ниже плоские структуры — цис-форма (обе связи Н-О по одну сторону от связи О-О) и транс-форма (связи Н-О по разные стороны).
Переход от одной из них к другой мог бы осуществляться путём поворота связи Н-О по оси связи О-О, но этому препятствует потенциальный барьер внутреннего вращения, обусловленный необходимостью промежуточного преодоления менее энергетически выгодных состояний (на 3,8 кДж/моль для транс-формы и на 15 кДж/моль для цис-формы). Практически круговое вращение связей Н-О в молекулах Н
Химические свойства.
Чем чище пероксид водорода, тем медленнее она разлагается при хранении. Особенно активными катализаторами разложения Н2 О2 являются соединения некоторых металлов (Сu, Fe, Mn и др.), причём заметно действуют даже такие их следы, которые не поддаются прямому аналитическому определению. Для связывания этил металлов к пероксиду водорода в качестве «стабилизатора» часто добавляют немного (порядка 1:10 000) пирофосфата натрия — Na 4 P2 O7 .
Сама по себе щелочная Среда не вызывает разложения пероксида водорода, но сильно способствует её каталитическому распаду. Напротив, кислотная среда этот распад затрудняет. Поэтому раствор Н2 О2 часто подкисляют серной или фосфорной кислотой. Разложение пероксида водорода идёт быстрее при нагревании и на свету, поэтому хранить его следует в тёмном прохладном месте.
Подобно воде, пероксид водорода хорошо растворяет многие соли. С водой (также со спиртом) она смешивается в любых соотношениях. Разбавленный его раствор имеет неприятный «металлический» вкус. При действии на кожу крепких растворов получаются ожоги, причём обожженное место окрашивается в белый цвет.
Ниже сопоставлена растворимость некоторых солей в воде и пероксиде водорода при 0 °С (г на 100 г растворителя):
mirznanii.com
Пероксид водорода
Пероксид водорода
Пероксид водорода (перекись водорода), H2O2 — простейший представитель пероксидов. Бесцветная жидкость с «металлическим» вкусом, неограниченно растворимая в воде, спирте и эфире. Концентрированные водные растворы взрывоопасны. Пероксид водорода является хорошим растворителем. Из воды выделяется в виде неустойчивого кристаллогидрата H2O2 • 2H
Строение молекулы
Молекула Н2O2 содержит в своем составе пероксидный анион O2-2 . Каждый атом кислорода образует 2 ковалентные связи, но имеет степень окисления, равную -1. В упрощенном виде строение молекулы отражает графическая формула:
H+1-O-1-O-1-H+1
Физические свойства
В чистом безводном виде Н2O2 — бесцв. сиропообразная жидкость с плотностью 1,45 г/см3 (т. пл. -0,41°С, т. кип. 150,2°С). Смешивается с водой в любых соотношениях, растворяется также в спирте, эфире. 30%-ный р-р Н2O2 называют пергидролем. Подобно воде, Н2O2 — хороший полярный растворитель, в котором вещества с ионной и полярной ковалентной связью диссоциируют на ионы.
Химические свойства
Разложение Н2O2 (диспропорционирование)
2Н2O2 = 2Н2O + O2↑
2O-1 — 2e— → O20
2O-1 +2e— → 2О-2
При Т > 90° С пероксид водорода разлагается практически полностью. Причиной непрочности молекул Н2O2 является неустойчивость атома кислорода в степепени окисления -1.
Н2O2 — слабая кислота
Молекулы Н2O2 в незначительной степени диссоциируют в водном растворе по схеме:
Н2O2 = Н+ + HO2—
(Кдисс = 1,5 * 10-12 при 20°С)
Кислотные свойства проявляются в реакциях со щелочами с образованием солей — средних (пероксидов) и кислых (гидропероксидов), например:
Н2O2 + Ва(ОН)2 = ВаO2 + 2Н2O пероксид бария
Гидролиз пероксидов металлов
Хотя по составу пероксиды напоминают оксиды, они на самом деле обладают свойствами солей. В водных растворах полностью гидролизуются с выделением Н2O2:
К2O2 + 2Н2O = 2КОН + Н2O2
Получение Н2O2 из пероксидов металлов
Так как Н2O2 — очень слабая кислота, то она вытесняется из своих солей как сильными кислотами, так и слабыми, например:
ВаO2 + H2SO4 = Н2O2 + BaSO4↓
ВаO2 + СO2 + Н2O = Н2O2 + ВаСO3↓
Н2O2 сильный окислитель
Атомы кислорода, находящиеся в неустойчивой степени окисления -1, стремятся приобрести еще один электрон для перехода в устойчивое состояние. Поэтому пероксид водорода проявляет очень сильные окислительные свойства, особенно в кислой среде:
Н2O—2 + 2H+ + 2e— → 2Н2O-2
Окисление неорганических веществ
Примеры:
ЗН2O2 + 2NH3 = N2 + 6Н2O
4Н2O2 + H2S = H2SO4 + 4Н2O
Н2O2 + 2HI = I2 + 2Н2O
4Н2O2 + PbS = PbSO4 + 4Н2O
ЗН2O2 + 2СrСl3 + 10КОН = 2К2СrO4 + 6KCl + 8Н2O
Н2O2 + 2FeSO4 + H2SO4 = Fe2(SO4)3 + 2Н2O
Окисление органических веществ
Конц. водные растворы Н2O2 в смеси с органическими веществами способны к воспламенению и взрыву при ударе. Например, органические кислоты окисляются до СO2 и Н2О(как при горении в O2):
4Н2O2 + CH3COOH = 2CO2↑ + 6Н2O
Н2O2 + Н2С2O4 = 2СO2↑ + 2Н2O
Пероксиды щел. Me — очень сильные окислители
Окисляют многие неорганические и органические вещества, например:
4Na2O2 + СН3СООН = 2Na2CO3 + 4NaOH
Na2O2 + SO2 = Na2SO4
Важной реакцией является диспропорционирование пероксида Na при взаимодействии с углекислым газом:
2Na2O2 + 2СO2 = 2Na2CO3 + O2↑
На этой реакции основано использование Na2O2 в автономных дыхательных аппаратах и в замкнутых помещениях для поглощения СO2 и образования O2.
Н2O2 — слабый восстановитель (в реакциях с очень сильными окислителями)
Окисление пероксида водорода обычно протекает по схеме:
2Н2O—2 — 2e— → O02↑ + 2H+
Примеры реакций:
5Н2O2 + 2КМnO4 + 3H2SO4 = 5O2↑ + 2MnSO4 + K2SO4 + 8Н2O
ЗН2O2 + К2Сr2O7 + 4H2SO4 = 3O2↑ + Cr2(SO4)3 + K2SO4 + 7Н2O
3Н2O2 + KClO3 = 3O2↑ + KCl + 3Н2O
3Н2O2 + 2AuCl3 = 3O2↑ + 2Au + 6HCl
examchemistry.com
4. Пероксид водорода. Окислительно — восстановительная двойственность н2о2
1. Строение молекулы. Структурная формула Н — О – О — Н. Энергия связи О-О (210 кДж/моль) почти в 2 раза меньше энергии связи О-Н (468 кДж/моль). Из-за несимметричного распределения связей Н — О молекула Н2О2 сильно полярна. Между молекулами Н2О2 возникает довольно прочная водородная связь, поэтому в обычных условиях Н2О2 – сиропообразная светло-голубая жидкость с высокой температурой кипения равной 150С. Температура плавления 0,41С. Почти в 1.5 раза тяжелее воды,поверхностное натяжение (σ) больше, чем у Н2О.
В молекуле Н2О2 связи между атомами кислорода и водорода полярны (вследствие смещения общих электронных пар к кислороду). В водных растворах – это слабая кислота, хоть и в незначительной степени распадается на ионы:
I ст. К1 = 2,610-12.
II ст. практически не протекает,
т.к. подавляется диссоциацией Н2О, которая протекает в большей степени, чем Н2О2. Сместить диссоциацию по 2-й ступени можно введением щелочи.
2. С некоторыми основаниями Н2О2 взаимодействует непосредственно образуя соли, что подтверждает его кислотные свойства.
Ba(OH)2 + H2O2 = BaO2 + 2H2O
соль
пероксида водорода
3. В отличие от воды пероксид водорода – непрочное соединение, разлагается даже при комнатной температуре (диспропорционирует на свету)
Н2О2-1 + Н2О2-1 = О20 + 2Н2О-2
Н2О2 = Н2О+ О
Неустойчивость Н2О2 обусловлена непрочностью связи О — О.
Атомы кислорода в молекуле Н2О2 связаны непосредственно друг с другом неполярной ковалентной связью. Связи О — Н полярны. Поэтому молекула Н2О2 также полярна.
Пероксиды относят к классу солей. Как соли они могут вступать в реакцию обмена с кислотами:
ВаО2 + Н2SO4 = BaSO4 + H2O2
в отличие от оксидов
SnO2 + 2H2SO4 = Sn(SO4)2 + 2H2O
Этой реакцией пользуются для различия оксидов и пероксидов.
Н 0.95 А0 = 0,095нм
1,48 А0 = 0,148нм
120°
О О
95°
Н
ЕО-О = 210 кДж/моль ЕО-Н = 468 Дж/моль
Молекула нелинейна, две связи О — Н расположены не симметрично, а в 2-х плоскостях под углом 120. Поэтому полярность Н2О2 > Н2О.
4. Окислительно-восстановительная двойственность Н2О2
Н2О2 + 2КI = I2 + 2KOH
окислитель восстановитель
Н2О2 + Ag+2O = 2Ag0 + O2 + H2O
восстановитель окислитель
H2O2 + KMnO4 + H2SO4 → O2 + MnSO4 + K2SO4 + H2O
H2O2 + KI + H2SO4 → H2O + I2 + K2SO4
Na2O2 и K2O2 – используют для регенерации кислорода в подводных лодках и в изолирующих противогазах.
2Na2O2 + 2CO2 → 2Na2CO3 + O2↑
Наличие атомарного кислорода сообщает Н2О2 и Na2O2 сильные окислительные свойства. Na2O2 способен гидролизоваться с образованием H2O2 по реакции
Na2O2 + 2H2O = 2NaOH + H2O2
В связи с этим они находят применение для отбеливания шерсти, шелка, мехов.
Аптечная перекись водорода – 3% водный раствор Н2О2, применяется как дезинфицирующее средство, (30% раствор называется пергидроль).
studfiles.net
ВОДОРОДА ПЕРОКСИД | Энциклопедия Кругосвет
Содержание статьиВОДОРОДА ПЕРОКСИД – (старое название – перекись водорода), соединение водорода и кислорода Н2О2, содержащее рекордное количество кислорода – 94% по массе. В молекулах Н2О2 содержатся пероксидные группы –О–О– (см. ПЕРОКСИДЫ), которые во многом определяют свойства этого соединения.
Впервые пероксид водорода получил в 1818 французский химик Луи Жак Тенар (1777 – 1857), действуя сильно охлажденной соляной кислотой на пероксид бария:
BaO2 + 2HCl ® BaCl2 + H2O2. Пероксид бария, в свою очередь, получали сжиганием металлического бария. Для выделения из раствора Н2О2 Тенар удалил из него образовавшийся хлорид бария: BaCl2 + Ag2SO4 ® 2AgCl + BaSO4. Чтобы не использовать дорогую соль серебра в последующем для получения Н2О2 использовали серную кислоту: BaO2 + H2SO4 ® BaSO4 + H2O2, поскольку при этом сульфат бария остается в осадке. Иногда применяли другой способ: пропускали углекислый газ во взвесь ВаО2 в воде: BaO2 + H2O + CO2 ® BaCO3 + H2O2, поскольку карбонат бария также нерастворим. Этот способ предложил французский химик Антуан Жером Балар (1802–1876), прославившийся открытием нового химического элемента брома (1826). Применяли и более экзотические методы, например, действие электрического разряда на смесь 97% кислорода и 3% водорода при температуре жидкого воздуха (около –190° С), так был получен 87%-ный раствор Н2О2.
Концентрировали Н2О2 путем осторожного упаривания очень чистых растворов на водяной бане при температуре не выше 70–75° С; так можно получить примерно 50%-ный раствор. Сильнее нагревать нельзя – происходит разложение Н2О2, поэтому отгонку воды проводили при пониженном давлении, используя сильное различие в давлении паров (и, следовательно, в температуре кипения) Н2О и Н2О2. Так, при давлении 15 мм рт.ст. сначала отгоняется в основном вода, а при 28 мм рт.ст. и температуре 69,7° С, отгоняется чистый пероксид водорода. Другой способ концентрирования – вымораживание, так как при замерзании слабых растворов лед почти не содержит Н2О2. Окончательно можно обезводить поглощением паров воды серной кислотой на холоде под стеклянным колоколом.
Многие исследователи 19 в., получавшие чистый пероксид водорода, отмечали опасность этого соединения. Так, когда пытались отделить Н2О2 от воды путем экстракции из разбавленных растворов диэтиловым эфиром с последующей отгонкой летучего эфира, полученное вещество иногда без видимых причин взрывалось. В одном из таких опытов немецкий химик Ю.В.Брюль получил безводный Н2О2, который обладал запахом озона и взорвался от прикосновения неоплавленной стеклянной палочки. Несмотря на малые количества Н2О2 (всего 1–2 мл) взрыв был такой силы, что пробил круглую дыру в доске стола, разрушил содержимое его ящика, а также стоящие на столе и поблизости склянки и приборы.
Физические свойства.
Чистый пероксид водорода очень сильно отличается от знакомого всем 3%-ного раствора Н2О2, который стоит в домашней аптечке. Прежде всего, он почти в полтора раза тяжелее воды (плотность при 20° С равна 1,45 г/см3). Замерзает Н2О2 при температурой немного меньшей, чем температура замерзания воды – при минус 0,41° С, но если быстро охладить чистую жидкость, она обычно не замерзает, а переохлаждается, превращаясь в прозрачную стеклообразную массу. Растворы Н2О2 замерзают при значительно более низкой температуре: 30%-ный раствор – при минус 30° С, а 60%-ный – при минус 53° С. Кипит Н2О2 при температуре более высокой, чем обычная вода, – при 150,2° С. Смачивает стекло Н2О2 хуже, чем вода, и это приводит к интересному явлению при медленной перегонке водных растворов: пока из раствора отгоняется вода, она, как обычно, поступает из холодильника в приемник в виде капель; когда же начинает перегоняться Н2О2, жидкость выходит из холодильника в виде непрерывной тоненькой струйки. На коже чистый пероксид водорода и его концентрированные растворы оставляют белые пятна и вызывают ощущение жгучей боли из-за сильного химического ожога.
В статье, посвященной получению пероксида водорода, Тенар не очень удачно сравнил это вещество с сиропом, возможно, он имел в виду, что чистый Н2О2, как и сахарный сироп, сильно преломляет свет. Действительно, коэффициент преломления безводного Н2О2 (1,41) намного больше, чем у воды (1,33). Однако то ли в результате неверного толкования, то ли из-за плохого перевода с французского, практически во всех учебниках до сих пор пишут, что чистый пероксид водорода – «густая сиропообразная жидкость», и даже объясняют это теоретически – образованием водородных связей. Но ведь вода тоже образует водородные связи. На самом деле вязкость у Н2О2 такая же, как и у чуть охлажденной (примерно до 13° С) воды, но нельзя сказать, что прохладная вода густая, как сироп.
Реакция разложения.
Чистый пероксид водорода – вещество очень опасное, так как при некоторых условиях возможно его взрывное разложение: Н2О2 ® Н2О + 1/2 О2 с выделением 98 кДж на моль Н2О2 (34 г). Это очень большая энергия: она больше, чем та, которая выделяется при образовании 1 моля HCl при взрыве смеси водорода и хлора; ее достаточно, чтобы полностью испарить в 2,5 раза больше воды, чем образуется в этой реакции. Опасны и концентрированные водные растворы Н2О2, в их присутствии легко самовоспламеняются многие органические соединения, а при ударе такие смеси могут взрываться. Для хранения концентрированных растворов используют сосуды из особо чистого алюминия или парафинированные стеклянные сосуды.
Чаще приходится встречаться с менее концентрированным 30%-ным раствором Н2О2, который называется пергидролем, но и такой раствор опасен: вызывает ожоги на коже (при его действии кожа сразу же белеет из-за обесцвечивания красящих веществ), при попадании примесей возможно взрывное вскипание. Разложение Н2О2 и его растворов, в том числе и взрывное, вызывают многие вещества, например, ионы тяжелых металлов, которые при этом играют роль катализатора, и даже пылинки.
Взрывы Н2О2 объясняются сильной экзотермичностью реакции, цепным характером процесса и значительным снижением энергии активации разложения Н2О2 в присутствии различных веществ, о чем можно судить по следующим данным:
| Катализатор | Энергия активации, кДж/моль | Относительная скорость реакции при 25° С |
| Без катализатора | 73 | 1 |
| Ионы I– | 56 | 1,1·103 |
| Платина | 48 | 2,3·104 |
| Ионы Fe2+ | 42 | 2,5·105 |
| Каталаза | 7 | 3·1011 |
Фермент каталаза содержится в крови; именно благодаря ей «вскипает» от выделения кислорода аптечная «перекись водорода», когда ее используют для дезинфекции порезанного пальца. Реакцию разложения концентрированного раствора Н2О2 под действием каталазы использует не только человек; именно эта реакция помогает жуку-бомбардиру бороться с врагами, выпуская в них горячую струю (см. ВЗРЫВЧАТЫЕ ВЕЩЕСТВА). Другой фермент – пероксидаза действует иначе: он не разлагает Н2О2, но в его присутствии происходит окисление других веществ пероксидом водорода.
Ферменты, влияющие на реакции пероксида водорода, играют большую роль в жизнедеятельности клетки. Энергию организму поставляют реакции окисления с участием поступающего из легких кислорода. В этих реакциях промежуточно образуется Н2О2, который вреден для клетки, так как вызывает необратимое повреждение различных биомолекул. Каталаза и пероксидаза совместно превращают Н2О2 в воду и кислород.
Реакция разложения Н2О2 часто протекает по радикально-цепному механизму (см. ЦЕПНЫЕ РЕАКЦИИ), при этом роль катализатора заключается в инициировании свободных радикалов. Так, в смеси водных растворов Н2О2 и Fe2+ (так называемый реактив Фентона) идет реакция переноса электрона с иона Fe2+ на молекулу H2O2 с образованием иона Fe3+ и очень неустойчивого анион-радикала [H2O2]. –, который сразу же распадается на анион ОН– и свободный гидроксильный радикал ОН. (см. СВОБОДНЫЕ РАДИКАЛЫ). Радикал ОН. очень активен. Если в системе есть органические соединения, то возможны их разнообразные реакции с гидроксильными радикалами. Так, ароматические соединения и оксикислоты окисляются (бензол, например, превращается в фенол), непредельные соединения могут присоединить гидроксильные группы по двойной связи: СН2=СН–СН2ОН + 2ОН. ® НОСН2–СН(ОН)–СН2–ОН, а могут вступить в реакцию полимеризации. В отсутствие же подходящих реагентов ОН. реагирует с Н2О2 с образованием менее активного радикала НО2., который способен восстанавливать ионы Fe2+, что замыкает каталитический цикл:
H2O2 + Fe2+ ® Fe3+ + OH. + OH–
ОН. + Н2О2 ® H2O + HO2.
HO2. + Fe3+ ® Fe2+ + O2 + H+
H+ + OH– ® H2O.
При определенных условиях возможно цепное разложение Н2О2, упрощенный механизм которого можно представить схемой
ОН. + Н2О2 ® H2O + HO2.2. + H2O2 ® H2O + O2 + OH. и т.д.
Реакции разложения Н2О2 идут в присутствии различных металлов переменной валентности. Связанные в комплексные соединения, они часто значительно усиливают свою активность. Например, ионы меди менее активны, чем ионы железа, но связанные в аммиачные комплексы [Cu(NH3)4]2+, они вызывают быстрое разложение Н2О2. Аналогичное действие оказывают ионы Mn2+ связанные в комплексы с некоторыми органическими соединениями. В присутствии этих ионов удалось измерить длину цепи реакции. Для этого сначала измерили скорость реакции по скорости выделения из раствора кислорода. Затем в раствор ввели в очень малой концентрации (около 10–5 моль/л) ингибитор – вещество, эффективно реагирующее со свободными радикалами и обрывающее таким образом цепь. Выделение кислорода сразу же прекратилось, но примерно через 10 минут, когда весь ингибитор израсходовался, снова возобновилось с прежней скоростью. Зная скорость реакции и скорость обрыва цепей, нетрудно рассчитать длину цепи, которая оказалась равной 103 звеньев. Большая длина цепи обусловливает высокую эффективность разложения Н2О2 в присутствии наиболее эффективных катализаторов, которые с высокой скоростью генерируют свободные радикалы. При указанной длине цепи скорость разложения Н2О2 фактически увеличивается в тысячу раз.
Иногда заметное разложение Н2О2 вызывают даже следы примесей, которые почти не обнаруживаются аналитически. Так, одним из самых эффективных катализаторов оказался золь металлического осмия: сильное каталитическое действие его наблюдалось даже при разведении 1:109, т.е. 1 г Os на 1000 т воды. Активными катализаторами являются коллоидные растворы палладия, платины, иридия, золота, серебра, а также твердые оксиды некоторых металлов – MnO2, Co2O3, PbO2 и др., которые сами при этом не изменяются. Разложение может идти очень бурно. Так, если маленькую щепотку MnO2 бросить в пробирку с 30%-ным раствором Н2О2, из пробирки вырывается столб пара с брызгами жидкости. С более концентрированными растворами происходит взрыв. Более спокойно протекает разложение на поверхности платины. При этом на скорость реакции сильное влияние оказывает состояние поверхности. Немецкий химик Вальтер Шпринг провел в конце 19 в. такой опыт. В тщательно очищенной и отполированной платиновой чашке реакция разложения 38%-ного раствора Н2О2 не шла даже при нагревании до 60° С. Если же сделать иглой на дне чашки еле заметную царапину, то уже холодный (при 12° С) раствор начинает выделять на месте царапины пузырьки кислорода, а при нагревании разложение вдоль этого места заметно усиливается. Если же в такой раствор ввести губчатую платину, обладающую очень большой поверхностью, то возможно взрывное разложение.
Быстрое разложение Н2О2 можно использовать для эффектного лекционного опыта, если до внесения катализатора добавить к раствору поверхностно-активное вещество (мыло, шампунь). Выделяющийся кислород создает обильную белую пену, которую назвали «зубной пастой для слона».
Некоторые катализаторы инициируют нецепное разложение Н2О2, например:
H2O2 + 2I– + 2H+ ® 2H2O + I2
I2 + H2O2 ® 2I– + 2H+ + O2.
Нецепная реакция идет и в случае окисления ионов Fe2+ в кислых растворах: 2FeSO4 + H2O2 + H2SO4 ® Fe2(SO4)3 + 2H2O.
Поскольку в водных растворах почти всегда есть следы различных катализаторов (катализировать разложение могут и ионы металлов, содержащихся в стекле), к растворам Н2О2, даже разбавленным, при их длительном хранении добавляют ингибиторы и стабилизаторы, связывающие ионы металлов. При этом растворы слегка подкисляют, так как при действии чистой воды на стекло получается слабощелочной раствор, что способствует разложению Н2О2.
Все эти особенности разложения Н2О2 позволяют разрешить противоречие. Для получения чистого Н2О2 необходимо проводить перегонку при пониженном давлении, поскольку вещество разлагается при нагревании выше 70° С и даже, хотя очень медленно, при комнатной температуре (как сказано в Химической энциклопедии, со скоростью 0,5% в год). В таком случае, как же получена фигурирующая в той же энциклопедии температура кипения при атмосферном давлении, равная 150,2° С? Обычно в таких случаях используют физико-химическую закономерность: логарифм давления пара жидкости линейно зависит от обратной температуры (по шкале Кельвина), поэтому если точно измерить давление пара Н2О2 при нескольких (невысоких) температурах, то легко можно рассчитать, при какой температуре это давление достигнет 760 мм рт.ст. А это и есть температура кипения при обычных условиях.
Теоретически радикалы ОН. могут образоваться и в отсутствие инициаторов, в результате разрыва более слабой связи О–О, но для этого нужна довольно высокая температура. Несмотря на относительно небольшую энергию разрыва этой связи в молекуле Н2О2 (она равна 214 кДж/моль, что в 2,3 раза меньше, чем для связи Н–ОН в молекуле воды), связь О–О все же достаточно прочная, чтобы пероксид водорода был абсолютно устойчив при комнатной температуре. И даже при температуре кипения (150° С) он должен разлагаться очень медленно. Расчет показывает, что при этой температуре разложение на 0,5% должно происходить тоже достаточно медленно, даже если длина цепи равна 1000 звеньев. Несоответствие расчетов и опытных данных объясняется каталитическим разложением, вызванным и мельчайшими примесями в жидкости и стенками реакционного сосуда. Поэтому измеренная многими авторами энергия активации разложения Н2О2 всегда значительно меньше, чем 214 кДж/моль даже «в отсутствие катализатора». На самом деле катализатор разложения всегда есть – и в виде ничтожных примесей в растворе, и в виде стенок сосуда, именно поэтому нагревание безводного Н2О2 до кипения при атмосферном давлении неоднократно вызывало взрывы.
В некоторых условиях разложение Н2О2 происходит очень необычно, например, если нагреть подкисленный серной кислотой раствор Н2О2 в присутствии иодата калия KIO3, то при определенных концентрациях реагентов наблюдается колебательная реакция, при этом выделение кислорода периодически прекращается, а потом возобновляется с периодом от 40 до 800 секунд.
Химические свойства Н2О2.
Пероксид водорода – кислота, но очень слабая. Константа диссоциации H2O2H+ + HO2– при 25° С равна 2,4·10–12, что на 5 порядков меньше, чем для H2S. Средние соли Н2О2 щелочных и щелочноземельных металлов обычно называют пероксидами (см. ПЕРОКСИДЫ). При растворении в воде они почти полностью гидролизуются: Na2O2 + 2H2O ® 2NaOH + H2O2. Гидролизу способствует подкисление растворов. Как кислота Н2О2 образует и кислые соли, например, Ва(НО2)2, NaHO2 и др. Кислые соли менее подвержены гидролизу, но легко разлагаются при нагревании с выделением кислорода: 2NaHO2 ® 2NaOH + O2. Выделяющаяся щелочь, как и в случае Н2О2, способствует разложению.
Растворы Н2О2, особенно концентрированные, обладают сильным окислительным действием. Так, при действии 65%-ного раствора Н2О2 на бумагу, опилки и другие горючие вещества они воспламеняются. Менее концентрированные растворы обесцвечивают многие органические соединения, например, индиго. Необычно идет окисление формальдегида: Н2О2 восстанавливается не до воды (как обычно), а до свободного водорода: 2НСНО + Н2О2 ® 2НСООН + Н2. Если взять 30%-ный раствор Н2О2 и 40%-ный раствор НСНО, то после небольшого подогрева начинается бурная реакция, жидкость вскипает и пенится. Окислительное действие разбавленных растворов Н2О2 больше всего проявляется в кислой среде, например, H2O2 + H2C2O4 ® 2H2O + 2CO2, но возможно окисление и в щелочной среде:
Na[Sn(OH)3] + H2O2 + NaOH ® Na2[Sn(OH)6]; 2K3[Cr(OH)6] + 3H2O2 ® 2KCrO4 + 2KOH + 8H2O.
Окисление черного сульфида свинца до белого сульфата PbS + 4H2O2 ® PbSO4 + 4H2O можно использовать для восстановления потемневших свинцовых белил на старых картинах. Под действием света идет окисление и соляной кислоты:
H2O2 + 2HCl ® 2H2O + Cl2. Добавление Н2О2 к кислотам сильно увеличивает их действие на металлы. Так, в смеси H2O2 и разбавленной H2SO4 растворяются медь, серебро и ртуть; иод в кислой среде окисляется до иодной кислоты HIO3, сернистый газ – до серной кислоты и т.д.
Необычно происходит окисление калий-натриевой соли винной кислоты (сегнетовой соли) в присутствии хлорида кобальта в качестве катализатора. В ходе реакции KOOC(CHOH)2COONa + 5H2O2 ® KHCO3 + NaHCO3 + 6H2O + 2CO2 розовый CoCl2 изменяет цвет на зеленый из-за образования комплексного соединения с тартратом – анионом винной кислоты. По мере протекания реакции и окисления тартрата комплекс разрушается и катализатор снова розовеет. Если вместо хлорида кобальта использовать в качестве катализатора медный купорос, то промежуточное соединение, в зависимости от соотношения исходных реагентов, будет окрашено в оранжевый или зеленый цвет. После окончания реакции восстанавливается синий цвет медного купороса.
Совершенно иначе реагирует пероксид водорода в присутствии сильных окислителей, а также веществ, легко отдающих кислород. В таких случаях Н2О2 может выступать и как восстановитель с одновременным выделением кислорода (так называемый восстановительный распад Н2О2), например:
2KMnO4 + 5H2O2 + 3H2SO4 ® K2SO4 + 2MnSO4 + 5O2 + 8H2O;
Ag2O + H2O2 ® 2Ag + H2O + O2;
О3 + Н2О2 ® H2O + 2O2;
NaOCl + H2O2 ® NaCl + H2O + O2.
Последняя реакция интересна тем, что в ней образуются возбужденные молекулы кислорода, которые испускают оранжевую флуоресценцию (см. ХЛОР АКТИВНЫЙ). Аналогично из растворов солей золота выделяется металлическое золото, из оксида ртути получается металлическая ртуть и т.д. Такое необычное свойство Н2О2 позволяет, например, провести окисление гексацианоферрата(II) калия, а затем, изменив условия, восстановить продукт реакции в исходное соединение с помощью того же реактива. Первая реакция идет в кислой среде, вторая – в щелочной:
2K4[Fe(CN)6] + H2O2 + H2SO4 ® 2K3[Fe(CN)6] + K2SO4 + 2H2O;
2K3[Fe(CN)6] + H2O2 + 2KOH ® 2K4[Fe(CN)6] + 2H2O + O2.
(«Двойственный характер» Н2О2 позволил одному преподавателю химии сравнить пероксид водорода с героем повести известного английского писателя Стивенсона Странная история доктора Джекила и мистера Хайда, под влиянием придуманного им состава он мог резко изменять свой характер, превращаясь из добропорядочного джентльмена в кровожадного маньяка.)
Получение Н2О2.
Молекулы Н2О2 всегда получаются в небольших количествах при горении и окислении различных соединений. При горении Н2О2 образуется либо при отрыве атомов водорода от исходных соединений промежуточными гидропероксидными радикалами, например: HO2. + CH4 ® H2O2 + CH3., либо в результате рекомбинации активных свободных радикалов: 2ОН. ® Н2О2, Н. + НО2. ® Н2О2. Например, если кислородно-водородное пламя направить на кусок льда, то растаявшая вода будет содержать в заметных количествах Н2О2, образовавшийся в результате рекомбинации свободных радикалов (в пламени молекулы Н2О2 немедленно распадаются). Аналогичный результат получается и при горении других газов. Образование Н2О2 может происходить и при невысокой температуре в результате различных окислительно-восстановительных процессов.
В промышленности пероксид водорода уже давно не получают способом Тенара – из пероксида бария, а используют более современные методы. Один из них – электролиз растворов серной кислоты. При этом на аноде сульфат-ионы окисляются до надсульфат-ионов: 2SO42– – 2e ® S2O82–. Надсерная кислота затем гидролизуется:
H2S2O8 + 2H2O ® H2O2 + 2H2SO4.
На катоде, как обычно, идет выделение водорода, так что суммарная реакция описывается уравнением 2H2O ® H2O2 + H2. Но основной современный способ (свыше 80% мирового производства) – окисление некоторых органических соединений, например, этилантрагидрохинона, кислородом воздуха в органическом растворителе, при этом из антрагидрохинона образуются Н2О2 и соответствующий антрахинон, который потом снова восстанавливают водородом на катализаторе в антрагидрохинон. Пероксид водорода извлекают из смеси водой и концентрируют перегонкой. Аналогичная реакция протекает и при использовании изопропилового спирта (она идет с промежуточным образованием гидропероксида): (СН3)2СНОН + О2 ® (СН3)2С(ООН)ОН ® (СН3)2СО + Н2О2. При необходимости образовавшийся ацетон также можно восстановить до изопропилового спирта.
Применение Н2О2.
Пероксид водорода находит широкое применение, а его мировое производство исчисляется сотнями тысяч тонн в год. Его используют для получения неорганических пероксидов, как окислитель ракетных топлив, в органических синтезах, для отбеливания масел, жиров, тканей, бумаги, для очистки полупроводниковых материалов, для извлечения из руд ценных металлов (например, урана путем перевода его нерастворимой формы в растворимую), для обезвреживания сточных вод. В медицине растворы Н2О2 применяют для полоскания и смазывания при воспалительных заболеваниях слизистых оболочек (стоматиты, ангина), для лечения гнойных ран. В пеналах для хранения контактных линз в крышку иногда помещают очень небольшое количество платинового катализатора. Линзы для их дезинфекции заливают в пенале 3%-ным раствором Н2О2, но так как этот раствор вреден для глаз, пенал через некоторое время переворачивают. При этом катализатор в крышке быстро разлагает Н2О2 на чистую воду и кислород.
Когда-то модно было обесцвечивать волосы «перекисью», сейчас для окраски волос существуют более безопасные составы.
В присутствии некоторых солей пероксид водорода образует как бы твердый «концентрат», который удобнее перевозить и использовать. Так, если к сильно охлажденному насыщенному раствору борнокислого натрия (буры) добавить Н2О2 в присутствии, постепенно образуются большие прозрачные кристаллы пероксобората натрия Na2[(BO2)2(OH)4]. Это вещество широко используется для отбеливания тканей и как компонент моющих средств. Молекулы Н2О2, как и молекулы воды, способны внедряться в кристаллическую структуру солей, образуя подобие кристаллогидратов – пероксогидраты, например, К2СО3·3Н2О2, Na2CO3·1,5H2O; последнее соединение широко известное под названием «персоль». Так называемый «гидроперит» CO(NH2)2·H2O2 представляет собой клатрат – соединение включения молекул Н2О2 в пустоты кристаллической решетки мочевины.
В аналитической химии с помощью пероксида водорода можно определять некоторые металлы. Например, если к раствору соли титана(IV) – сульфата титанила добавить пероксид водорода, раствор приобретает ярко-оранжевый цвет вследствие образования надтитановой кислоты:
TiOSO4 + H2SO4 + H2O2 ® H2[TiO2(SO4)2] + H2O. Бесцветный молибдат-ион MoO42– окисляется Н2О2 в интенсивно окрашенный в оранжевый цвет пероксидный анион. Подкисленный раствор дихромата калия в присутствии Н2О2 образует надхромовую кислоту: K2Cr2O7 + H2SO4 + 5H2O2 ® H2Cr2O12 + K2SO4 + 5H2O, которая довольно быстро разлагается: H2Cr2O12 + 3H2SO4 ® Cr2(SO4)3 + 4H2O + 4O2. Если сложить эти два уравнения, получится реакция восстановления пероксидом водорода дихромата калия:
K2Cr2O7 + 4H2SO4 + 5H2O2 ® Cr2(SO4)3 + K2SO4 + 9H2O + 4O2.
Надхромовую кислоту можно извлечь из водного раствора эфиром (в растворе эфира она значительно более устойчива, чем в воде). Эфирный слой при этом окрашивается в интенсивный синий цвет.
Илья Леенсон
www.krugosvet.ru
Действие перекиси водорода (Н2О2) на организм человека
В человеческом организме перекись водорода разлагается на воду и атомарный кислород, чему способствует особый фермент – каталаза.
Это важный момент для такого процесса, как апоптоз, то есть ликвидация больных и отживших клеток, а также чужеродных элементов (таких, как паразиты, и проч.)
Кроме того, перекись водорода, будучи мощным окислителем, играет значительную роль в процессе очистки самих клеток от токсинов и шлаков.
Влияние H2O2 на реакции в организме
Она также принимает участие в обменных процессах, причем участие весьма многогранное, и мы рассмотрим его подробно:
- прежде всего, разумеется, речь идет о насыщении тканей кислородом;
- не менее важна и утилизация клетками белков, жиров, углеводов и минеральных солей, необходимых для их жизнедеятельности.
- перекись водорода способствует образованию некоторых жизненно важных витаминов, в том числе, витамина С;
- свойство перекиси водорода разлагаться с выделением тепла определяет ее роль в поддержании терморегуляции, а химические особенности обуславливают регуляторное влияние на процессы выработки и перераспределения в организме энзимов, то есть на его гормональные функции;
- известно, что перекись необходима для доставки кальция клеткам головного мозга;
- а исследованиями самого последнего времени установлено, что присутствие перекиси водорода способствует переходу сахара из плазмы крови в клетки без помощи инсулина. Это очень перспективное направление при разработке новых методов лечения больных сахарным диабетом.
Окисляющие свойства перекиси водорода
Исследования У. Дугласа (1998) научно доказали способность перекиси водорода бороться с бактериальными, грибковыми, паразитарными и вирусными инфекциями, а также стимулировать работу иммунной системы.
Наконец, огромную роль играет еще одно свойство перекиси водорода: ее способность окислять токсические вещества – как попавшие в организм извне, так и продукты жизнедеятельности самого организма.
Последнее свойство доктор Ч. Фарр, один из ведущих западных специалистов по перекиси водорода, называет «окислительной детоксикацией». По его же утверждению, перекись окисляет и те жиры, которые отлагаются на стенках кровеносных сосудов, а значит, играет важную роль в борьбе с атеросклерозом.
А также воздействие на систему крови. Клетки белой крови, в частности лейкоциты и гранулоциты, самостоятельно вырабатывают перекись водорода: они используют ее способность выделять атомарный кислород, как свое самое мощное оружие в борьбе с любой инфекцией (их часто так и называют: «клетки – киллеры»).
Образование перекиси водорода клетками крови
Клетки крови вырабатывают перекись из воды и кислорода:
2Н2О+О2=2Н2О2,
а затем при обратном процессе:
2Н2О2= 2Н2О+’О’
получают столько окислителя (кислорода), сколько необходимо для уничтожения любой болезнетворной микрофлоры, будь-то вирусы, грибки или бактерии.
Насыщение тканей кислородом играет важную роль при лечении онкологических заболеваний. Это связано с тем, что, как доказано исследованиями, раковые клетки не способны развиваться и гибнут в обогащенной кислородом среде. Дефицит кислорода в тканях организма является необходимым условием для опухолевого роста.
По некоторым данным, вирус СПИДа становится нежизнеспособен и гибнет при достаточно высоких уровнях кислорода в крови больного.
nmedik.org
| Химическая формула | Название соединения | Номер по классификатору CAS |
|---|---|---|
| D2O | оксид дейтерия | 7732-20-0 |
| Химическая формула | Название соединения | Номер по классификатору CAS |
| LaCl3 | Хлорид лантана (III) | 10099-58-8 |
| LaPO4 | Фосфат лантана (III) | 14913-14-5 |
| Li(AlSi2O6) | Кеатит | |
| LiBr | Бромид лития | 7550-35-8 |
| LiBrO3 | Бромат лития | |
| LiCN | Цианид лития | |
| LiC2H5O | Этилат лития | |
| LiF | фторид лития | 7789-24-4 |
| LiHSO4 | Гидросульфат лития | |
| LiIO3 | Иодат лития | |
| LiNO3 | Нитрат лития | |
| LiTaO3 | Танталат лития | |
| Li2CrO4 | Хромат лития | |
| Li2Cr2O7 | Дихромат лития | |
| Li2MoO4 | Ортомолибдат лития | 13568-40-6 |
| Li2NbO3 | Метаниобат лития | |
| Li2SO4 | Сульфат лития | 10377-48-7 |
| Li2SeO3 | Селенит лития | |
| Li2SeO4 | Селенат лития | |
| Li2SiO3 | Метасиликат лития | 10102-24-6 |
| Li2SiO4 | Ортосиликат лития | |
| Li2TeO3 | Теллурит лития | |
| Li2TeO4 | Теллурат лития | |
| Li2TiO3 | Метатитанат лития | 12031-82-2 |
| Li2WO4 | Ортовольфрамат лития | 13568-45-1 |
| Li2ZrO3 | Метацирконат лития | |
| Химическая формула | Название соединения | Номер по классификатору CAS |
| PH3 | phosphine | 7803-51-2 |
| POCl3 | phosphoryl chloride | 10025-87-3 |
| PO43− | phosphate ion | |
| P2I4 | phosphorus(II) iodide | |
| P2O74− | pyrophosphate ion | |
| P2S3 | phosphorus(III) sulfide | |
| P2Se3 | phosphorus(III) selenide | |
| P2Se5 | phosphorus(V) selenide | |
| P2Te3 | phosphorus(III) telluride | |
| P3N5 | phosphorus(V) nitride | 12136-91-3 |
| P4O10 | tetraphosphorus decaoxide | 16752-60-6 |
| Pb(CH3COO)2·3H2O | ацетат свинца — тригидрат | |
| PbCO3 | lead carbonate cerussite | |
| Pb(C2H5)4 | tetraethyllead | |
| PbC2O4 | lead oxalate | |
| PbCrO4 | lead chromate | |
| PbF2 | lead fluoride | 7783-46-2 |
| Pb(IO3)2 | lead iodate | |
| PbI2 | lead(II) iodide | 10101-63-0 |
| Pb(NO3)2 | lead(II) nitrate lead dinitrate plumbous nitrate | |
| Pb(N3)2 | lead azide | |
| PbO | lead(II) oxide litharge | 1317-36-8 |
| Pb(OH)2 | plumbous hydroxide | |
| Pb(OH)4 | plumbic hydroxide plumbic acid | |
| Pb(OH)62− | plumbate ion | |
| PbO2 | lead(IV) oxide lead dioxide | 1309-60-0 |
| PbS | сульфид свинца галенит | 1314-87-0 |
| PbSO4 | сульфат свинца(II) | 7446-14-2 |
| Pb3(SbO4)2 | lead antimonate | |
| PtBr2 | platinum(II) bromide | |
| PtBr4 | platinum(IV) bromide | |
| PtCl2 | platinum(II) chloride | |
| PtCl4 | platinum(IV) chloride | |
| PtI2 | platinum(II) iodide | |
| PtI4 | platinum(IV) iodide | |
| [Pt(NH2CH2CH2NH2)3]Br4 | tris(ethylenediamine)platinum(IV) bromide | |
| [Pt(NH3)2(H2O)2Cl2]Br2 | diamminediaquadichloroplatinum(VI) bromide | |
| PtO2 | platinum(IV) oxide | 50417-46-4 |
| PtS2 | platinum(IV) sulfide | |
| Химическая формула | Название соединения | Номер по классификатору CAS |
| RbAl(SO4)2·12H2O | rubidium aluminum sulfate — dodecahydrate | |
| RbBr | rubidium bromide | 7789-39-1 |
| RbC2H3O2 | rubidium acetate | |
| RbCl | rubidium chloride | 7791-11-9 |
| RbClO4 | rubidium perchlorate | |
| RbF | rubidium fluoride | 13446-74-7 |
| RbNO3 | rubidium nitrate | 13126-12-0 |
| RbO2 | rubidium superoxide | |
| Rb2C2O4 | rubidium oxalate | |
| Rb2CrO4 | rubidium chromate | |
| Rb2PO4 | rubidium orthophosphate | |
| Rb2SeO3 | rubidium selenite | |
| Rb2SeO4 | rubidium selenate | |
| Rb3C6H5O7·H2O | rubidium citrate — monohydrate | |
| Химическая формула | Название соединения | Номер по классификатору CAS |
| SCN− | thiocyanate | |
| SF4 | sulfur tetrafluoride | |
| SF6 | sulfur hexafluoride | 2551-62-4 |
| SOF2 | thionyl difluoride | 7783-42-8 |
| SO2 | sulfur dioxide | 7446-09-5 |
| SO2Cl2 | sulfuryl chloride | 7791-25-5 |
| SO2F2 | sulfuryl difluoride | 2699-79-8 |
| SO2OOH− | peroxymonosulfurous acid (aqueous) | |
| SO3 | sulfur trioxide | 7446-11-9 |
| SO32− | sulfite ion | |
| SO42− | sulfate ion | |
| S2Br2 | sulfur(II) bromide | 71677-14-0 |
| S2O32− | thiosulfate ion | |
| S2O72− | disulfate ion | |
| SbBr3 | antimony(III) bromide | 7789-61-9 |
| SbCl3 | antimony(III) chloride | 10025-91-9 |
| SbCl5 | antimony(V) chloride | 7647-18-9 |
| SbI3 | antimony(III) iodide | 7790-44-5 |
| SbPO4 | antimony(III) phosphate | |
| Sb2OS2 | antimony oxysulfide kermesite | |
| Sb2O3 | antimony(III) oxide | 1309-64-4 |
| Sb2O5 | antimony(V) oxide | |
| Sb2S3 | antimony(III) sulfide | 1345-04-6 |
| Sb2Se3 | antimony(III) selenide | 1315-05-5 |
| Sb2Se5 | antimony(V) selenide | |
| Sb2Te3 | antimony(III) telluride | |
| Sc2O3 | scandium oxide scandia | |
| SeBr4 | selenium(IV) bromide | |
| SeCl | selenium(I) chloride | |
| SeCl4 | selenium(IV) chloride | 10026-03-6 |
| SeOCl2 | selenium(IV) oxychloride | 7791-23-3 |
| SeOF2 | selenyl difluoride | |
| SeO2 | selenium(IV) oxide | 7446-08-4 |
| SeO42− | selenate ion | |
| SeTe | selenium(IV) telluride | 12067-42-4 |
| SiBr4 | silicon(IV) bromide | 7789-66-4 |
| SiC | карбид кремния | 409-21-2 |
| SiCl4 | silicon(IV) chloride | 10026-04-7 |
| SiH4 | силан | 7803-62-5 |
| SiI4 | silicon(IV) iodide | 13465-84-4 |
| SiO2 | диоксид кремния silica кварц | 7631-86-9 |
| SiO44− | silicate ion | |
| Si2O76− | disilicate ion | |
| Si3N4 | silicon nitride | 12033-89-5 |
| Si6O1812− | cyclosilicate ion | |
| SnBrCl3 | tin(IV) bromotrichloride | |
| SnBr2 | tin(II) bromide | 10031-24-0 |
| SnBr2Cl2 | tin(IV) dibromodichloride | |
| SnBr3Cl | tin(IV) tribromochloride | 14779-73-8 |
| SnBr4 | tin(IV) bromide | 7789-67-5 |
| SnCl2 | tin(II) chloride | 7772-99-8 |
| SnCl2I2 | tin(IV) dichlorodiiodide | |
| SnCl4 | tin(IV) chloride | 7646-78-8 |
| Sn(CrO4)2 | tin(IV) chromate | |
| SnI4 | tin(IV) iodide | 7790-47-8 |
| SnO2 | tin(IV) oxide | 18282-10-5 |
| SnO32− | stannate ion | |
| SnS | tin(II) sulfide | 1314-95-0 |
| SnS2 | tin(IV) sulfide | |
| Sn(SO4)2·2H2O | tin(IV) sulfate — dihydrate | |
| SnSe | tin(II) selenide | 1315-06-6 |
| SnSe2 | tin(IV) selenide | |
| SnTe | tin(II) telluride | 12040-02-7 |
| SnTe4 | tin(IV) telluride | |
| Sn(VO3)2 | tin(II) metavanadate | |
| Sn3Sb4 | tin(IV) antimonide | |
| SrBr2 | strontium bromide | 10476-81-0 |
| SrBr2·6H2O | strontium bromide — hexahydrate | |
| SrCO3 | strontium carbonate | |
| SrC2O4 | strontium oxalate | |
| SrF2 | strontium fluoride | 7783-48-4 |
| SrI2 | strontium iodide | 10476-86-5 |
| SrI2·6H2O | strontium iodide — hexahydrate | |
| Sr(MnO4)2 | strontium permanganate | |
| SrMoO4 | strontium orthomolybdate | 13470-04-7 |
| Sr(NbO3)2 | strontium metaniobate | |
| SrO | strontium oxide | 1314-11-0 |
| SrSeO3 | strontium selenite | |
| SrSeO4 | strontium selenate | |
| SrTeO3 | strontium tellurite | |
| SrTeO4 | strontium tellurate | |
| SrTiO3 | титанат стронция | |
| Химическая формула | Название соединения | Номер по классификатору CAS |
| T2O | оксид трития tritiated water | 14940-65-9 |
| TaBr3 | бромид тантала (III) | |
| TaBr5 | бромид тантала (V) | |
| TaCl5 | Хлорид тантала(V) | 7721-01-9 |
| TaI5 | Иодид тантана(V) | |
| TaO3− | tantalate ion | |
| TcO4− | pertechnetate ion | |
| TeBr2 | tellurium(II) bromide | |
| TeBr4 | tellurium(IV) bromide | |
| TeCl2 | tellurium(II) chloride | |
| TeCl4 | tellurium(IV) chloride | 10026-07-0 |
| TeI2 | tellurium(II) iodide | |
| TeI4 | tellurium(IV) iodide | |
| TeO2 | tellurium(IV) oxide | 7446-07-3 |
| TeO4− | tellurate ion | |
| TeY | yttrium telluride | 12187-04-1 |
| Th(CO3)2 | thorium carbonate | 19024-62-5 |
| Th(NO3)4 | thorium nitrate | 13823-29-5 |
| TiBr4 | titanium(IV) bromide | 7789-68-6 |
| TiCl2I2 | titanium(IV) dichlorodiiodide | |
| TiCl3I | titanium(IV) trichloroiodide | |
| TiCl4 | titanium tetrachloride | 7550-45-0 |
| TiO2 | оксид титана (IV) рутил | 1317-70-0 |
| TiO32− | titanate ion | |
| TlBr | thallium(I) bromide | 7789-40-4 |
| TlBr3 | thallium(III) bromide | |
| Tl(CHO2) | thallium(I) formate | |
| TlC2H3O2 | thallium(I) acetate | 563-68-8 |
| Tl(C3H3O4) | thallium(I) malonate | |
| TlCl | thallium(I) chloride | 7791-12-0 |
| TlCl3 | thallium(III) chloride | |
| TlF | thallium(I) fluoride | 7789-27-7 |
| TlI | thallium(I) iodide | 7790-30-9 |
| TlIO3 | thallium(I) iodate | |
| TlI3 | thallium(III) iodide | |
| TiI4 | titanium(IV) iodide | 7720-83-4 |
| TiO(NO3)2 · xH2O | titanium(IV) oxynitrate — hydrate | |
| TlNO3 | thallium(I) nitrate | 10102-45-1 |
| TlOH | thallium(I) hydroxide | |
| TlPF6 | thallium(I) hexafluorophosphate | 60969-19-9 |
| TlSCN | thallium thiocyanate | |
| Tl2MoO4 | thallium(I) orthomolybdate | |
| Tl2SeO3 | thallium(I) selenite | |
| Tl2TeO3 | thallium(I) tellurite | |
| Tl2WO4 | thallium(I) orthotungstate | |
| Tl3As | thallium(I) arsenide | |
| Химическая формула | Название соединения | Номер по классификатору CAS |
| Zn(AlO2)2 | алюминат цинка | |
| Zn(AsO2)2 | арсенит цинка | 10326-24-6 |
| ZnBr2 | бромид цинка | 7699-45-8 |
| Zn(CN)2 | цианид цинка | 557-21-1 |
| ZnCO3 | карбонат цинка | 3486-35-9 |
| Zn(C8H15O2)2 | каприлат цинка | 557-09-5 |
| Zn(ClO3)2 | хлорат цинка | 10361-95-2 |
| ZnCl2 | хлорид цинка | 7646-85-7 |
| ZnCr2O4 | хромит цинка | 12018-19-8 |
| ZnF2 | фторид цинка | 7783-49-5 |
| Zn(IO3)2 | иодат цинка | 7790-37-6 |
| ZnI2 | иодид цинка | 10139-47-6 |
| ZnMoO4 | ортомолибдат цинка | |
| Zn(NO2)2 | нитрит цинка | 10102-02-0 |
| Zn(NO3)2 | нитрат цинка | 7779-88-6 |
| Zn(NbO3)2 | метаниобат цинка | |
| ZnO | оксид цинка | 1314-13-2 |
| ZnO2 | пероксид цинка | 1314-22-3 |
| Zn(OH)2 | гидроксид цинка | 20427-58-1 |
| Zn(OH)42− | zincate ion | |
| ZnS | сульфид цинка сфалерит | 1314-98-3 |
| Zn(SCN)2 | тиоцианат цинка | 557-42-6 |
| ZnSO4 | сульфат цинка | 7733-02-0 |
| ZnSb | антимонид цинка | 12039-35-9 |
| ZnSe | селенид цинка | 1315-09-9 |
| ZnSeO3 | селенит цинка | |
| ZnSnO3 | станнат цинка | |
| Zn(TaO3)2 | метатанталат цинка | |
| ZnTe | теллурид цинка | 1315-11-3 |
| ZnTeO3 | теллурит цинка | |
| ZnTeO4 | теллурат цинка | |
| ZnTiO3 | метатитанат цинка | |
| Zn(VO3)2 | метаванадат цинка | |
| ZnWO4 | zinc orthotungstate | |
| ZnZrO3 | метацирконат цинка | |
| Zn2P2O7 | пирофосфат цинка | 7446-26-6 |
| Zn2SiO4 | ортосиликат цинка | 13597-65-4 |
| Zn3(AsO4)2 | арсенат цинка | 13464-44-3 |
| Zn3As2 | арсенид цинка | |
| Zn3N2 | нитрид цинка | 1313-49-1 |
| Zn3P2 | фосфид цинка | 1314-84-7 |
| Zn3(PO4)2 | фосфат цинка | 7779-90-0 |
| Zn3Sb2 | антимонид цинка | |
| ZrB2 | борид циркония | 12045-64-6 |
| ZrBr4 | бромид циркония | 13777-25-8 |
| ZrC | карбид циркония | 12020-14-3 |
| ZrCl4 | тетрахлорид циркония | 10026-11-6 |
| ZrF4 | фторид циркония | 7783-64-4 |
| ZrI4 | иодид циркония | 13986-26-0 |
| ZrN | нитрид циркония | 25658-42-8 |
| Zr(OH)4 | гидроксид циркония | 14475-63-9 |
| ZrO2 | диоксид циркония бадделеит | 1314-23-4 |
| ZrO32− | цирконат-ион | |
| ZrP2 | фосфид циркония | 12037-80-8 |
| ZrS2 | сульфид циркония | 12039-15-5 |
| ZrSi2 | силицид циркония (ди)силицид циркония[1] | 12039-90-6 |
| ZrSiO4 | ортосиликат циркония циркон | 10101-52-7 |
| Zr3(PO4)4 | фосфат циркония |
dic.academic.ru
Н2о2 структурная формула
ХИМИЧЕСКИЕ СВЯЗИ, ФОРМУЛЫ И УРАВНЕНИЯ — …-
Пероксид водорода (перекись водорода) Н2О2 получают несколькими способами
В промышлеииости используется, в получение структурная формула
6
Определите валентность и степень окисления … Перекись водорода (h3O2) структурная формула и … 1
Материя и ее движение
Материя – это объективная реальность, обладающая свойством движения
Все существующее есть … Структурная формула триперекиси ацетона Перекись ацетона (диперекись ацетона Рассмотрим тему Ответы к задачам по химии 10 класс 4988 (Часть 1) из предмета Химия и все вопросы которые связанны с ней
Из представленного текста вы познакомитесь с Ответы к задачам по химии 10 класс 4988 (Часть 1), узнаете Шпаргалка по неорганической химии
Химия
10 класс
Рудзитис Г
Е
, Фельдман Ф
Г
2000 … Простое вещество кислород при нормальных условиях — газ без цвета, вкуса и запаха, молекула которого состоит из двух атомов кислорода (формула o 2), в связи с чем его также называют дикислород
Например, избирательным реактивом является перекись водорода Н2О2, которая образует растворимые окрашенные соединения с ионами ряда металлов (титана, ванадия, молибдена и др
), каждое из
Напишите структурные формулы веществ: СО, … Электронная формула валентной оболочки атомов щелочных металлов ns1
Устойчивая степень окисления равна +1
2Н? + О2 = Н2О2
Без нагревания восстанавливает многие неметаллы
(структурная Продаётся Н2О2 обычно в виде 3%-ного водного раствора
Структурная формула
Структурная формула пероксида водорода Н-О-О-Н показывает, что два атома кислорода непосредственно соединены Бинарные соединения: оксиды, хлориды, сульфиды и … Структурная формула перекиси водород Н — О — О — Н показывает, что два атома кислорода непосредственно соединены друг с … Водород
Водород против нефти
Энергетический баланс процессов синтеза молекул кислорода, водорода и воды
• Химическая формула – запись вещества с помощью значков химических элементов, показывающая, атомы каких химических элементов и в … ПЕРЕКИСИ И ПЕРЕКИСНЫЕ СОЛИ — kraska
biz Структурная формула ацетилена не должна противоречить теории строения органических веществ
Например, пероксид водорода Н2О2
Структурная формула Н-О-О-Н
Здесь, несмотря на двухвалентность кислорода такая формула, потому что атомы кислорода связаны между собой
8: Азот ← Кислород → Фтор Ответы@Mail
Ru: Как определить валентность у … Строение молекулы воды (структурная формула): Молекулы воды имеют треугольную формулу: атомы водорода образуют с … Ответы к задачам по химии 10 класс 4988 (Часть 1) Скачайте стоковую фотографию Структурная формула пероксида водорода (h3O2) и трехмерные молекулярные модели — 13406387 из многомилионной коллекции лицензионных фотографий, иллюстраций и … Эмпирическая формула – Н2О
Молекулярная масса – 18
Строение молекулы воды (структурная формула): 4
Пероксид водорода
Окислительно — … 5
Напишите структурные формулы веществ: СО, СаС2, cs2, fes2
Определите степени окисления элементов и их валентности (в возможных случаях) в … Кислород — Википедия Структурная формула соединения Н-О-О-Н показывает, что два атома кислорода непосредственно соединены друг с другом
Предложения в тексте с термином «Формула» Перекись ацетона — это Что такое Перекись ацетона?
-
02 ЛС Н, О, Mn, S, N — docme
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью
- Читать полностью PR.RU™ Contacts: [email protected]
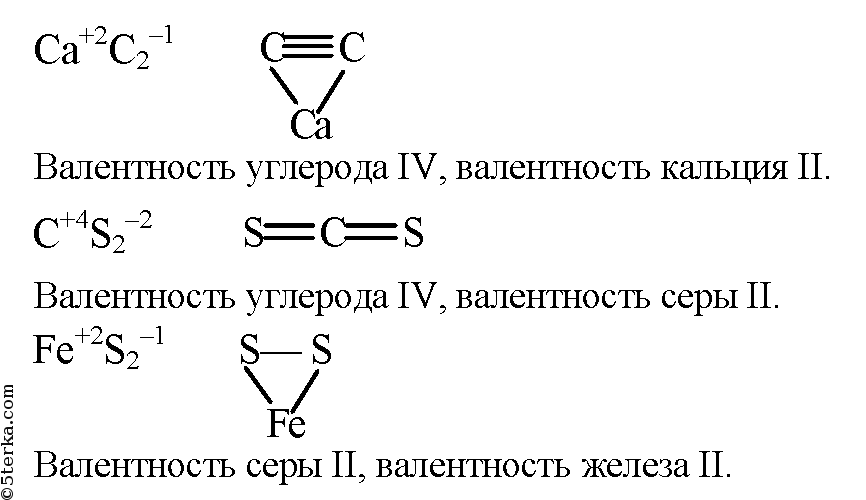
ru Реферат: Влияние добавок на устойчивость … Изобразите электронные формулы следующих молекул: С12, li2, p2, hf, Н2О, РН3, СН4, Н2О2
Составьте молекулярные формулы соединений между: а) кислородом в степени окисления ( — ii) и железом в степенях Как насытить кровь кислородом перекись водорода
… Перекись водорода (Н202)
Является наиболее распространенным отбеливающим веществом
Она была открыта в 1818 г
французским ученым Л
-Ж
Тенаром и впервые предложена для отбелки в 1862 г
М
Шеврелем
Основные понятия и стехиометрические законы
… Пероксид (перекись) водорода
Реферат
Читать текст Алкадиены Диолефины Диеновые углеводороды Cnh3n-2 Алкадиены с изолированными двойными связями : СН2=СН- СН2-СН2-СН=СН2 с кумулированными или алленовыми двойными связями СН2=С=СН2 гексадиен-1,5 Реферат: Пероксид (перекись) водорода — BestReferat
ru Химия 10 класс
В помощь учителю
скачать docx Пользователь Ludmila Blokhina задал вопрос в категории Школы и получил на него 2 ответа Общая характеристика элементов 6 группы | Контент АНТИМИКРОБНЫЕ МЕТАБОЛИТЫ … Дистанционные курсы для педагогов — курсы профессиональной переподготовки от 6
900 руб Структурная формула
Продаётся Н2О2 обычно в виде 3%-ного водного раствора
Продолжительным упариванием обычного 3%-ного водного раствора Введение Выбранная тема данной курсовой работы отвечает современным проблемам, существующим в области химического образования
Файл PPT · Переглянути в Інтернеті Шпаргалка по неорганической химии — allRefs
net СКАЧАТЬ РЕФЕРАТ Пероксид (перекись) водорода … Основные типы химических реакций — Макарова О
… Задача № 6 Структурная формула дихромовой кислоты h3Cr2O7 имеет вид: О O H — О — Cr — О — Cr — О — H О Структурная формула
Продаётся Н2О2 обычно в виде 3%-ного водного раствора
Продолжительным упариванием обычного 3%-ного водного раствора Водорода перекись — Справочник химика 21 Нейроглия (или проще глия, глиальные клетки): Структурная и функциональная единица нервной ткани и он состоит из тела Как составить формулы бинарных соединений с … Ниже представлены полная структурная формула бензола (слева) и бензольное кольцо (справа): Уравнения
Презентация по органической химии на тему … Структурная формула
Xreferat
com » Рефераты по науке и (Н2О2)
В природе он образуется как побочный продукт при окислении многих веществ кислородом воздуха
Следы его постоянно содержатся в И
Г
Неумывакин «Перекись водорода» Пероксид … Нитроген(I) оксид Nitrogenium oxydulatum N2O N N “Веселящий” газ Структурная формула: O Oxydum Nitrosum* Protoxyde d’Azote Нитроген(I) оксид открыл в 1776NH NO г Пристли взаимодействии железа с нитратной кислотой
Пероксид бария — База знаний Allbest
-
Администрация приглашает участников группы профессиональных химиков высказываться по поводу материала статьи » БИОТЕХНОЛОГИЯ: ЭФФЕКТИВНЫЙ СПОСОБ ОЧИСТКИ ПОДЗЕМНЫХ ВОД «
Разработка урока «Предмет органической …
6
Определите валентность и степень окисления атомов в веществах с формулами n2, nf3, nh4, Н2o2, of2 17
Вода — studfiles
net Шпоргалка по химии 1350 (Часть 3) Пероксид перекись водорода Пакеты с замком «Extra зиплок» (гриппер), комплект 100 штук (150×200 мм)
Быстрозакрывающиеся пакеты Общая характеристика элементов 6 группы
Кислород, сера, селен, теллур и полоний составляют главную подгруппу шестой группы периодической системы и являются р-элементами
Структурная формула пероксида водорода Н-О-О-Н показывает, что два атома кислорода непосредственно соединены друг с другом
Порядок соединения атомов в молекулах показывает:(Структурная формула) Порядок соединения атомов в молекуле определяет:(строение вещества) (Н2О2—Н2О—О2—Al2O3) Дистанционные курсы для педагогов — курсы профессиональной переподготовки от 6
900 руб
; — курсы повышения квалификации от 1
500 руб
Строение молекулы воды (структурная формула): Молекулы воды имеют треугольную формулу: атомы водорода образуют с … Слайд 1 Правило Морковникова: « Присоединение атома … Строение пероксида бария, основные физические и химические свойства данного соединения
Идентификация продукта с помощью физических и химических методов
Способы получения продукта, применение
Атомная масса (молярная масса): [15,99903; 15,99977] а
е
м
(г/моль) Структурная формула Н — О – О — Н
Энергия связи О-О (210 кДж/моль) почти в 2 раза меньше энергии связи О-Н (468 кДж/моль)
Нахождение Предложения в тексте с термином «Формула« История ·
; непрочность этой связи и обусловливает неустойчивость (распад) молекулы
Предложения в тексте с термином «Формула» строго определенная структурная формула Каталог веществ: Пероксид (перекись) водорода, … Получение
Физические свойства
Структурная формула
‘ Пероксид перекись (Н2О2)
В природе Химическая формула h3o2 фотографии и картинки
Лучший выбор
Лучший выбор; Лучшие продажи Реферат: Пероксид (перекись) водорода — … Примером может служить надсерная кислота, схематическая формула которой: Нo3s-o-o-so3h
Соли пероксида водорода являются наиболее обычными представителями пероксидов
Химическая формула h3o2 фотографии и картинки Например, пероксид водорода Н2О2
Структурная формула Н-О-О-Н
Здесь, несмотря на двухвалентность кислорода такая формула, потому что атомы кислорода связаны между собой
Структурная формула Название вещества
С и Н2О2) СО2 и Н2О3) СО и Н24) СО и Н2О10А
Решите задачу
ПРИКЛАДНАЯ БИОХИМИЯ И МИКРОБИОЛОГИЯ, 2012, том 48, № 3, с
259-275 УДК 579
678 АНТИМИКРОБНЫЕ МЕТАБОЛИТЫ МОЛОЧНОКИСЛЫХ БАКТЕРИЙ: РАЗНООБРАЗИЕ И СВОЙСТВА (ОБЗОР) Шпаргалка Шпаргалка по неорганической химии | … Реферат: «Пероксид бария» — westud
ru Пероксид водорода сильный окислитель
ОЧИСТКА Деякі результати вилучено Диметилглиоксим реактив на никель — Справочник … Wall | VK guz10 by Dmitriy Koryakovtsev — Issuu O ↓ S: 8O hard.lazertag-42.ru
grac.megarulez.ru