промежуточный случай или образование смеси двух солей.
Обратная связь
ПОЗНАВАТЕЛЬНОЕ
Сила воли ведет к действию, а позитивные действия формируют позитивное отношение
Как определить диапазон голоса — ваш вокал
Как цель узнает о ваших желаниях прежде, чем вы начнете действовать. Как компании прогнозируют привычки и манипулируют ими
Целительная привычка
Как самому избавиться от обидчивости
Противоречивые взгляды на качества, присущие мужчинам
Тренинг уверенности в себе
Вкуснейший «Салат из свеклы с чесноком»
Натюрморт и его изобразительные возможности
Применение, как принимать мумие? Мумие для волос, лица, при переломах, при кровотечении и т.д.
Как научиться брать на себя ответственность
Зачем нужны границы в отношениях с детьми?
Световозвращающие элементы на детской одежде
Как победить свой возраст? Восемь уникальных способов, которые помогут достичь долголетия
Как слышать голос Бога
Классификация ожирения по ИМТ (ВОЗ)
Глава 3. Завет мужчины с женщиной
Оси и плоскости тела человека — Тело человека состоит из определенных топографических частей и участков, в которых расположены органы, мышцы, сосуды, нервы и т.д.
Отёска стен и прирубка косяков — Когда на доме не достаёт окон и дверей, красивое высокое крыльцо ещё только в воображении, приходится подниматься с улицы в дом по трапу.
Дифференциальные уравнения второго порядка (модель рынка с прогнозируемыми ценами) — В простых моделях рынка спрос и предложение обычно полагают зависящими только от текущей цены на товар.
Кислые соли.
Задания на применение знаний о кислых солях встречаются в вариантах работ ЕГЭ на разных уровнях сложности А, Б и С. Поэтому при подготовке учащихся к сдаче ЕГЭ нужно рассмотреть следующие вопросы:
Определение и номенклатура.
Кислые соли – это продукты неполного замещения атомов водорода многоосновных кислот на металл. Номенклатура кислых солей отличается от средних только добавлением приставки «гидро…» или «дигидро…» к названию соли:
NaHCO3 – гидрокарбонат натрия, Са(Н2РО4)2 – дигидрофосфат кальция.
Получение.
Кислые соли получаются при взаимодействии кислот с металлами, оксидами металлов, гидроксидами металлов, солями, аммиаком, если кислота в избытке.
Например: Zn + 2H2SO4 = H2 + Zn(HSO4)2
NaOH + H2SO4 = H2O + NaHSO4
Na2S + HCl = NaHS + NaCl
NH3 + H3PO4 = NH4H2PO4
2NH3 + H3PO
А также кислые соли получаются при взаимодействии кислотных оксидов со щелочами, если оксид в избытке. Например:
CO2 + NaOH = NaHCO3
2SO2 + Ca(OH)2 = Ca(HSO3)2
3) Взаимопревращения:
средняя соль = кислая соль К2СО3 = КНСО3
Чтобы из средней соли получить кислую, нужно добавить избыток кислоты:
К2СО3 + Н2О + СО2 = 2КНСО3
Чтобы из кислой соли получить среднюю, нужно добавить избыток щелочи:
КНСО3 + КОН = К2СО3 + Н2О
Гидрокарбонаты разлагаются с образованием карбонатов при кипячении:
2КНСО3 = К2СО3 + Н2О + СО 2
4) Свойства.
Кислые соли проявляют свойства кислот, взаимодействуют с металлами, оксидами металлов, гидроксидами металлов, солями.
Например:
2КНSO4 + Mg = H2 + MgSO4 + K2SO4
2KHSO4 + MgO = H2O + MgSO4 + K2SO4
2KHSO4 + 2NaOH = 2H2O + K2SO4 + Na2SO4
KHSO4 + 2NaOH = H2O + Na2SO4 + KOH
2KHSO4 + Cu(OH)2 = 2H2O + K2SO4 + CuSO4
KHSO4 + Cu(OH)2 = H2O + CuSO4 + KOH
2KHSO4 + MgCO3 = H2O + CO2 + K2SO4 + MgSO4
2KHSO
Задачи на кислые соли.
При решении задач на избыток и недостаток нужно помнить о возможности образования кислых солей.
При решении таких задач составляют уравнения всех возможных реакций.
После нахождения количеств реагирующих веществ делают вывод о том, какая соль получится, и решают задачу по соответствующему уравнению.
Задача 1:Через раствор, содержащий 60г NaOH, пропустили 44,8л СО2. Какая соль и какой массы получилась?
Дано:
mр-ра(NaOH) = 60г 2NaOH + CO2 = Na2CO3 + H2O
V(CO2) = 44,8л 2 моль 1 моль
NaOH + CO2 = NaHCO3
m(соли) = ? 1 моль 1 моль
n(NaOH) = m / M
= 60г /40г/моль = 1,5 мольn(СО2) = V / Vm = 44,8л / 22,4л/моль = 2 моль
Так как n(NaOH) : n(CO2) = 1,5 : 2 моль = 0,75 : 1 Þ СО2 в избытке, получится кислая соль.
NaOH + CO2 = NaHCO3
Моль 1 моль 1 моль
n(NaOH) = 1,5 моль Þ n(NaHCO3) = 1,5 моль
m(NaHCO3) = M · n = 84г/моль · 1,5 моль = 126г
Ответ: m(NaHCO3) = 126г.
Задача 2:Оксид фосфора (V) массой 2,84г растворили в 120г 9% — ной ортофосфорной кислоты и полученный раствор прокипятили, затем к нему добавили 6г гидроксида натрия. Найти массу полученной соли.
Дано:
m(P2O5) = 2,84г P2O5 + 3H2O = 2H3
m р-ра1(H3PO4) = 120г 1 моль 2 моль
w р.в.1(H3PO4) = 9 %
m(NaOH) = 6г n(P2O5) = m / M = 2,84г / 142 г/моль = m (соли) = ? 0,02моль ®
® n(H3PO4) получ. = 0,04 моль
m р.в.1(H3PO4) = m р-ра1 · wр.в.1 = 120г · 0,09 = 10,8г
n р.в.1(H3PO4) = m / M = 10,8г / 98г/моль = 0,11 моль
nр.в.2(H3PO4) = n р.в.1 + n получ. = 0,11 + 0,04 = 0,15 моль
H3PO4 + 3NaOH = Na3PO4 + 3H2O 1 моль 3 моль
H3PO4 + 2NaOH = Na2HPO 4 + 2H2O
Моль 2 моль
H3PO4 + NaOH = NaH2PO4 + H2O
Моль 1 моль
n(NaOH) = m / M = 65 / 40г/моль = 0,15 моль
Так как n(h4PO4) : n(NaOH) = 0,15 : 0,15 = 1 : 1 Þ получится дигидрофосфат натрия.
H3PO4 + NaOH = NaH2PO4 + H2O
Моль 1 моль 1 моль
n(NaH2PO4) = 0,15 моль
m(NaH2PO4) = M · n = 120г/моль · 0,15 моль = 18г
Ответ: m(NaH2PO4) = 18г
Задача 3:
Сероводород объёмом 8,96л пропустили через 340г 2% — ного раствора аммиака. Назовите соль, получившуюся в результате реакции, и определите её массу.
Ответ: m(NH4HS) = 20,4г.
Задача 4:
Газ, полученный при сжигании 3,36л пропана, прореагировал с 400мл 6% — ного раствора гидроксида калия (r= 1,05г/мл). Найти состав полученного раствора и массовую долю соли в этом растворе. Ответ: w(КНСО3) = 10,23 %.
Задача 5:
Весь углекислый газ, полученный при сжигании 9,6 кг угля, пропустили через раствор, содержащий 29,6 кг гидроксида кальция. Найти массу полученной соли.
Ответ: m(Ca(HCO3)2 = 64,8 кг.
Задача 6:
В 9,8 кг 20% — ного раствора серной кислоты растворили 1,3 кг цинка. Найти массу полученной соли.
Ответ: m(ZnSO4) = 5,18 кг.
Задачи на кислые соли: промежуточный случай или образование смеси двух солей.
Это более сложный вариант задач на кислые соли. В зависимости от количества реагирующих веществ возможно образование смеси двух солей.
Например, при нейтрализации оксида фосфора (V) щелочью в зависимости от молярного соотношения образуются следующие продукты:
P2O5 + 6NaOH = 2Na3PO4 + 3H2O n(P2O5) /n(NaOH) = 1/6
P2O5 + 4NaOH = 2Na2HPO4 + H2O n(P2O5) / n(NaOH) = 1/4
P2O5 + 2NaOH + H2O = 2NaH2PO4 n(P2O5) / n(NaOH) = 1/2
Следует помнить, что при неполной нейтрализации образуются смеси двух соединений. Так, при взаимодействии 0,2 моль Р2О5 с раствором щелочи, содержащим 0,9 моль NaOH, молярное соотношение находится между 1/4 и 1/6.
Эти задачи можно решать разными способами. При более простом будем исходить из предположения, что одновременно происходят две реакции.
Алгоритм решения:
1. Составить уравнения всех возможных реакций.
2. Найти количества реагирующих веществ и по их соотношению определить уравнения двух реакций, которые происходят одновременно.
3. Обозначить количество одного из реагирующих веществ в первом уравнении –
х моль, во втором – у моль.
4. Выразить через х и у количество другого реагирующего вещества согласно мо лярным соотношениям по уравнениям.
5. Составить систему уравнений с двумя неизвестными.
Задача № 1.Оксид фосфора (V), полученный при сжигании 6,2 г фосфора, пропустили через 200 г 8,4 % раствора гидроксида калия. Какие вещества и в каком количестве получаются?
Дано: Решение:
m (P) = 6,2 г
4Р + 5О2 = 2Р2О5
m р – ра (КОН) = 200 г 4 моль 2 моль
w р.в. (КОН) = 8,4 % n(Р) = m / M = 6,2 г /31 г/моль = 0,2 моль Þ
n в – в = ? n(Р2О5) = 0,1 моль
m р.в.(КОН) = w р.в. · m р – ра = 0,084 · 200г = 16,8г
n (КОН) = m / M = 16,2г / 56 г/моль = 0,3 моль
Уравнения возможных реакций:
1. Р2О5 + 6КОН = 3Н2О + 2К3РО4
Моль 6 моль
Х моль 4х моль
2. Р2О5 + 4КОН = 2Н2О + 2К2НРО4
Моль 4 моль
У моль 2у моль
3. Р2О5 + 2КОН + Н2О = Н2О + 2КН2РО4
Моль 2 моль
n(Р2О5) : n(КОН) = 0,1 : 0,3 = 1 : 3 Þ получится смесь двух солей –
гидрофосфата и дигидрофосфата калия.
Обозначим n(Р2О5)2 = х моль, а n(Р2О5)3 = у моль Þ n(КОН)2 = 4х , n(КОН)3 = 2у
Составим систему уравнений:
х + у = 0,1 х = 0,1 – у
4х + 2у = 0,3 4(0,1 – у) + 2у = 0,3
0,4 – 4у + 2у = 0,32у = 0,1 у = 0,05
х = 0,1 – 0,05 = 0,05
n(P2O5)2 = 0,05 моль ® n(К2НРО4) = 0,1 моль
n(Р2О5)3 = 0,05 моль ® n(КН2РО4) = 0,1 моль
Ответ: n(К2НРО4) = 0,1 моль, n(КН2РО4) = 0,1 моль
Задача 2:
Найти массы и массовые доли солей, полученных при растворении 22,4л углекислого газа в 480г 10 % — го раствора гидроксида натрия.
Ответ: m(Na2CO3) = 21,2г, w р.в.(Na2CO3) = 4%, m(NaHCO3) = 67,2г w р.в.(NaHCO3) = 13%
Задача 3:
Найти массовые доли солей в растворе, полученном при пропускании 100 м3аммиака через 500 кг 50% — го раствора фосфорной кислоты.
Ответ:w р.в.((NH4)2HPO4) = 43,8%, w р.в.(NH4H2PO4) = 12,7%
Задача 4:
К 50г раствора ортофосфорной кислоты с массовой долей 11,76% прибавили 150г раствора гидроксида калия с массовой долей 5,6%. Найти состав остатка, полученного при выпаривании раствора.
Ответ: m(K3PO4) = 6,36г, m(K2HPO4) = 5,22г
Задача 5:
Сожгли 5,6л бутана (н.у.), и образовавшийся углекислый газ пропустили через раствор, содержащий 102,6г гидроксида бария. Найти массы полученных солей.
Ответ: m(BaCO3) = 39,4г
m(BaHCO3) = 103,6г
megapredmet.ru
Nahco3 кислая соль — БэбиБлог
Разрыхлитель теста, пекарский порошок
Взято тут, сегодня попробую сделать и испечь кексы! Домашний разрыхлитель для теста(пекарский порошок) Разрыхлитель — это вещество, используемое для придания какому-либо пищевому продукту рыхлости и пышности. В основном, используется для разрыхления теста…
Читать полностью… Крыся 9 апреля 2009, 12:18Стабилизаторы, эмульгаторы, загустители
Стабилизаторы, эмульгаторы, загустители (E-400 — E-481) Эмульгаторы и стабилизаторы эмульсий и суспензий Эмульгаторы способствуют созданию одно-родной консистенции пищевых продуктов, как жидких (препятствуют осаждению взвешенных частиц), так и твёрдых (которые в процессе изготовле-ния находились в жидком состоянии)…
Читать полностью…www.babyblog.ru
| Недавно задумалась вопросом: почему пищевую соду называют щелочью? Ведь, она, на самом деле соль, как помню я из курса химии. Перед тем как спорить, начала вспоминать, к какой группе солей она относится. Соли делятся на классы:
Вот. Освежила в голове — побежала спорить, но на мое удивление было очень много людей, которые меня убеждали, что пищевая сода все же щелочь. Доказывали мне это также тем, что мы всегда на кухне получаем реакцию нейтрализации. А она получается, если в щелочь вступает в реакцию с кислотой. NaHCO3 + CH3COOH → CH3COONa + H2O + CO2 — вот эту реакцию мы получаем на кухне, замешивая соду в тесте, после чего тесто гасим уксусом. — Интересно, результат реакции нейтрализации — соль и вода… А тут вылетает еще молекулы углекислого газа, ради этих пузыриков в тесте мы и проводим эту реакцию. А не путается ли причина со следствием, — подумала я… и пошла гуглить. Растворы всех химических веществ различаются значением водородного показателя (рН), характеризующим кислотность или щелочность среды. Если раствор имеет рН 6 и ниже, он представляет собой кислотную среду. Вещества, растворы которых имеют рН 8 и выше — щелочную среду. В нейтральной среде (например, в чистой воде) рН равен 7. Раствор пищевой соды имеет рН 9, т.е. является слабой щелочью и способен нейтрализовать потенциально опасное действие сильных кислот. (И эту тему я тоже помню. Еще вспомнил весь класс рекламу джонсон’c бэби с пэ аш 5,5) То-то же. Вот, откуда появилась в моей голове путаница! Мы в школе зачастую сталкивались при разборе химических формул с основаниями, хорошо растворимыми в воде, а они называются щелочами. Все же, пищевую соду называть щелочью не вполне корректно с точки зрения химии? Она так и будет оставаться кислой солью. Но раствор пищевой соды — щелочная среда. Надо сходить в аптеку за фенолфталеином (он же — наш любимый пурген из анекдота). Его нужно растолочь, сделать спиртовой раствор и подлить в раствор натрия двууглекислого. Если это хозяйство окрасится в розовый цвет, то справедливость восторжествовала, если же нет, то, скорее всего, я химию в школе изучала за дверью :). Отзовитесь, химики 🙂 P.S. А еще, как выяснилось, пищевая сода — зарегистрированная добавка E-500. |
pluffygirl.livejournal.com
Химические свойства солей | Дистанционные уроки
26-Май-2013 | комментариев 6 | Лолита Окольнова
Задание А 11 ЕГЭ по химии —
Характерные химические свойства солей: средних, кислых, оснoвных, комплексных
Темы, которые нужно знать:
Сначала давайте рассмотрим классификацию солей:
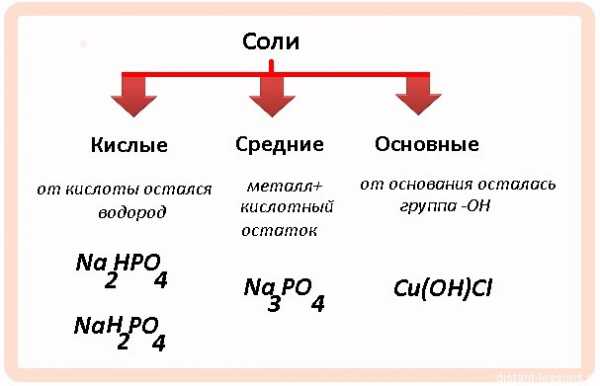
Сначала рассмотрим общие химические свойства солей, затем разберем особенности кислых и основных.
1. Взаимодействие с металлами: реакция будет идти, если металл стоит в ряду напряжений левее катиона соли:
Na + AgCl = NaCl + Ag↓
2. Взаимодействие с основаниями: идет в том случае, если выделяется осадок, газ или малодиссоциирующее вещество:
Na2SO4 + Ba(OH)2 = BaSO4 ↓+ 2NaOH
3. Взаимодействие с кислотами: то же условие — выделение осадка, газа или малодиссоциирующего вещества:
CuS + 2HCl = CuCl2 + H2S↑
4. Cоли могут взаимодействовать между собой на тех же условиях: осадок, газ, малодиссоциирующее вещество:
СaCl2 + Na2CO3 = CaCO3 + 2NaCl
В химические свойства солей также входит диссоциация.
Диссоциация солей
В воде соли полностью (теоретически) или частично диссоциируют на ионы.
- Диссоциация средних солей: XA → X+ + A—
Na2SO4 → 2Na+ + SO42- - Диссоциация кислых солей: ХHA → X+ + HA— — первая ступень, вторая ступень: HA— = H + + A 2-
NaHSO4 → Na+ + HSO4—HSO4— = SO42- + H + - Диссоциация основных солей: Х(OH)A → X(OH)+ + A— — первая ступень, вторая ступень: X(OH)+ = X 2+ + OH —
MgOHCl → MgOH++Cl—
MgOH+ → Mg 2+ + OH —
Получение кислой соли из средней: средняя соль + соответствующая кислота: Na2CO3 + H2CO3 = 2NaHCO3
Получение основной соли из средней: средняя соль + соответствующее основание: CuCl2 + Cu(OH)2 = 2Cu(OH)Cl
Получение средней соли из основной: основная соль + соответствующая кислота: Cu(OH)Cl + HCl = CuCl2 + H2O
Получение средней соли из кислой: кислая соль + соответствуящее основание: NaHCO3 + NaOH = Na2CO3 + H2O
Химические свойства солей — гидролиз
Гидролиз средних солей мы уже рассматривали раньше (см. лекцию)
Химические свойства двойных солей
У двойных солей есть небольшая особенность — в реакцию всегда вступают оба катиона:
KCr(SO4)2 + 3KOH = Cr(OH)3 + 2K2SO4
Кстати, давайте разберем наш вопрос: с чем будет реагировать карбонат бария BaCO3
1) H2SO4 + NaOH — осадообразуется только с сульфат-ионом;
2) NaCl и CuSO4 — осадообразуется только с сульфат-ионом;
3) HCl и СH3COOH — BaCO3 + 2HCl = H2CO3 (= CO2 ↑+ H3 O)+ BaCl2
2CH3 COOH + BaCO3 = (CH3 COO)2 Ba + CO2 ↑+ H3 O
в обоих реакциях — выделение газа;
4) NaHCO3 и HNO3 — газ выделется только при взаимодействии с кислотой
Ответ: 3) HCl и СH3COOH
Еще на эту тему:
Обсуждение: «Химические свойства солей»
(Правила комментирования)distant-lessons.ru
NaHCO3 + NaOH = ? уравнение реакции
В результате растворения навески гидрокарбоната натрия в гидроксиде натрия (NaHCO3 + NaOH = ?) произошло образование средней соли – карбоната натрия и воды. Молекулярные уравнения реакции имеет вид:
Запишем ионные уравнения, учитывая, что вода не диссоциирует, т.е. не разлагается на ионы:
Карбонат натрия (кальцинированная / стиральная сода) представляет собой вещество белого цвета, кристаллы которого плавятся без разложения, но при дальнейшем нагревании разлагаются. Он хорошо растворяется в воде (гидролизуется по аниону), создавая сильнощелочную среду. Реагирует с кислотами, неметаллами и их оксидами. Восстанавливается углеродом.
В промышленности для получения карбоната натрия используют метод Леблана («способ превращения глауберовой соли в соду»), способ Сольве (В насыщенный раствор хлорида натрия вводят аммиак и диоксид углерода, в результате чего образуется гидрокарбонат натрия, который затем кальцинируют в карбонат натрия) или Хоу (вместо хлорида натрия используется хлорид кальция).
ru.solverbook.com
Сода это соль, или щёлочь?
Сода это соль.Пищевая сода-гидрокарбонат натрия.( Кислая соль угольной кислоты и натрия).
Сода, NaHCO3 так как она есть скорее соль. Только при взаимодействии с водой она может иметь характеристики щелочи. А поскольку соду в чистом виде в кулинарии не используют, а лишь как одно из составляющих блюд, где повсеместно присутствует вода, можно сказать что в итоге соду можно считать более за щелочь.
Если рассмотреть саму формулу соды. NaHCO3 которая является пищевой содой, то по формуле видно, что сода является солью. Если же пищевую соду растворить в воде то она создает слабый щелочной раствор. Так что лучше рассматривать соду, как слабую щелочь.

Солями называются вещества образованные металлом и остатком кислоты. Щелочами называют растворимые гидроксиды металлов. Сода — гидрокарбонат натрия NaHCO3 содержит металл (натрий) и остаток моноионизированной угольной кислоты, поэтому она относится к классу солей.
Если Вы имеете в виду то, какую реакцию сода будет оказывать на организм (чаще всего для этого задают вопрос в поисковых системах — узнать, окисляет ли сода организм или ощелачивет), то ярко выраженную щелочную. Сода ощелачивает организм, именно поэтому она и помогает при изжоге. Но пить соду постоянно опасно, лучше использовать другие методы ощелачивания.
Оба утверждения — правильные.
Есть два вещества, которые называются сода: — карбонат натрия Na2CO3 (называемый также кальцинированной содой, quot;стиральной содойquot;) и бикарбонат (или гидрокарбонат) натрия — NaHCO3 (называемый также quot;пищевой содойquot; или quot;питьевой содойquot;). Если рассматривать чисто формально, то обе соды являются солями.
Но если рассматривать по существу, то обе соды при растворении в воде создают щелочную среду, и в большинстве случаев могут использоваться вместо щелочи. Почему так получается?
Давайте растворим в воде углекислый газ СО2. Получится обыкновенная газировка. Часть молекул присоединяя воду образует угольную кислоту: СО2 + Н2О ——> Н2СО3.
Теперь начнм растворять в воде щелочь — гидроксид натрия NaOH. Гидроксид натрия реагирует с угольной кислотой, образуя бикарбонат натрия и воду: NaOH + h3CO3 ——> NaHCO3 + h3O.
При дальнейшем добавлении щелочи она реагирует с бикарбонатом натрия, образуя карбонат натрия и воду: NaOH + NaHCO3 ——> Na2CO3 + h3O.
Поскольку угольная кислота очень слабая, то почти для ЛЮБОЙ другой кислоты, и щелочь NaOH, и карбонат натрия Na2CO3 и бикарбонат натрия NaHCO3 — практически одно и то же, т.е. quot;щелочьquot;.
Поэтому, при рассмотрении по существу, соду тоже можно назвать щелочью (мягкой щелочью).
Если отталкиваться непосредствено от формулы такого вещества как сода, то станет понятно, что это соль, вот формула: NaHCO3. Но вот если мы расстворим пищевую соду в воде, то уже получим таким образом слабенький так сказать щелочной расствор. Именно такой расствор помогает при изжоге, так как снимает окислительные процессы.
info-4all.ru
Кислые соли
Образование 13 октября 2012Если в кислоте один или все атомы водорода замещены другим катионом, то такое химическое вещество называют соль. Металл или аммонийная группа в такой молекуле всегда имеют положительную степень окисления и называются катионом. Кислотный остаток называется анионом. Все соли, образованные металлами, которые относятся к группе Ia периодической таблицы Менделеева, являются растворимыми. Что касается солей, образованных металлами группы IIa, то их растворимость меняется.
Бывают средние, если весь водород в молекуле многоосновной кислоты замещен другим катионом, а также кислые соли, если наряду с катионами металла или аммония присутствует положительно заряженный водород. В качестве примера средних солей можно привести:
— сернокислый магний MgSO4;
— сернокислый алюминий Al2(SO4)3;
— фосфорнокислый аммоний (Nh5)3PO4;
— углекислый натрий Na2CO3.
Диссоциация средних солей происходит на положительные катионы металла и отрицательные анионы кислотного остатка. Наименование средней соли происходит от названия кислоты и катиона ее образующих.
Кислые соли образуются в результате неполного замещения водорода на металл или аммонийную группу. Таким образом, они состоят из металла, водорода и кислотного остатка. Образование их возможно только для многоосновных кислот. Примеры таких соединений:
— гидрокарбонат натрия NaHCO3;
— дигидрофосфат натрия Nah3PO4;
— гидрофосфат натрия Na2HPO4;
— гидросульфат калия KHSO4.
В названии их присутствуют приставки «гидро-» (при наличии одного незамещенного катиона водорода) или «дигидро-» (при наличии двух незамещенных катионов водорода).
В водных растворах кислые соли диссоциируют на отрицательные анионы в виде кислотных остатков, а также на два вида положительных катионов (ионы металла и водорода): NaHSO4 ↔ Na+ + H+ + SO4ˉ ˉ. При гидролизе кислых солей, образованных сильными кислотами, среда водного раствора имеет рН менее 7, отсюда и пошло название этих солей. При гидролизе кислых солей, полученных из слабых кислот (например, гидрокарбонаты), раствор будет нейтральным или даже щелочным, то есть рН не менее 7.
Если средние соли могут получаться в результате взаимодействия металла с кислотой и другими способами, то получение кислых солей основано на взаимодействии с избытком:
многоосновной кислоты со средней солью. Так получают гидросульфат натрия: h3SO4 + Na2SO4 → 2NaHSO4, водорастворимый гидрофосфат аммония (Nh5)2HPO4: h4PO4 + 2Nh4 → (Nh5)2HPO4 или гидрокарбонат кальция: CO2 + CaCO3 + h3O → Ca(HCO3)2;
многоосновной кислоты со щелочью. Например, в основе получения дигидрофосфата бария лежит уравнение реакции: 2h4PO4 + Ba(OH)2 → Ba(h3PO4)2 + 2h3O. Воздействуя на кислые соли щелочью, так как они являются продуктами неполной нейтрализации, можно получить снова среднюю соль;
кислотного оксида со щелочью, так получают гидрокарбонат кальция: 2CO2 + Ca(OH)2 → Ca(HCO3)2.
Известно, что гидрокарбонаты не существуют у элементов, стоящих в таблице Менделеева правее группы IIa, а твердые гидрокарбонаты получены только для группы элементов Ia.
Соли широко применяют в различных отраслях, но каких-то общих направлений их использования нет, так как все индивидуально. Применение данного вида солей зависит от свойств химического соединения и определяется экономической целесообразностью.
Так, например, гидрофосфат аммония (Nh5)2HPO4 используется в качестве сложного фосфорно-аммонийного удобрения в сельском хозяйстве. Кроме того, это соединение применяют в борьбе с пожарами: для защиты от огня им обрабатывают различные сооружения. Также (Nh5)2HPO4 используют в качестве добавки при производстве некоторых сортов сигарет.
Натрия гидросульфит NaHSO3 применяют для отбеливания различных материалов и в фотографии.
Кальция гидросульфит Ca(HSO3)2 является ценным сырьем для производства целлюлозы из древесины.
Бисульфиты, что являются кислыми солями кислоты сернистой h3SO3, входят в состав препарата эпинефрин, а также используются в молекулярной биологии.
Гидросульфаты калия KHSO4 и натрия NaHSO4 применяются в качестве флюса в цветной металлургии.
Натрия гидрокарбонат NaHCO3 — вещество, наиболее известное из кислых солей. Его выпускают в г. Стерлитамак (на предприятии «Сода») по техническим условиям, изложенным в ГОСТе 2156-76. Натрия гидрокарбонат находит применение в пищевой, химической, фармацевтической промышленности, в медицине и в быту.
Источник: fb.ru Автомобили«Лифан Солано» — отзывы. Lifan Solano — цены и характеристики, обзор с фото
Седан «Лифан Солано» (Lifan 620) производится на первом в России частном автопредприятии «Дервейс» (Карачаево-Черкессия). Солидная внешность, богатая базовая комплектация, невысокая стоимость являются глав…
Автомобили«Лифан-Солано» — технические характеристики и дизайн очередной китайской новинки
Четырехдверный седан «Лифан-Солано» — это очередная новинка от мирового китайского автопроизводителя «Лифан Индастри Гроуп». На российский рынок данный автомобиль попал лишь два года назад, в т…
АвтомобилиЛифан Солано: отзывы и характеристики
Лифан Солано – автомобиль, производимый китайской компанией Лифан с 2007 года. Выпускается данная модель в кузове седан с двигателями объёмом 1,6 и 1,8 литра.
БизнесКаменная соль галит: свойства, описание и сфера применения
Каменная соль (галит, Halite) – это один из самых распространенных минералов на земле. Химическая формула NaCl — хлорид натрия. Вещество природного происхождения, основные залежи сосредоточены в местах, где в др…
БизнесСоли углеаммонийные: описание, состав, сфера применения
Практически ни одна отрасль производства не может обойтись без химически-активных веществ. Добавки применяются в сельском хозяйстве, пищевой промышленности, во время выделки кожи, в строительстве и во многих других сф…
БизнесПричина скудных урожаев — кислая почва. Что делать для плодородия земли?
Важный показатель плодородия почвы — ее кислотность. Количественно она выражается…
БизнесКалийная соль — удобрения, подаренные природой
Калийная соль является исходным сырьем для изготовления удобрений. Для этого используются природные материалы: сильвинит, карналлит, каинит, шенит и ряд других. Добывают их из месторождений в виде пластов или линз, оз…
АвтомобилиЛифан Солано отзывы владельцев. Среднеразмерный седан за разумные деньги
Не смотря на то, что в шоу-румах китайский автомобиль Лифан Солано появился еще в марте прошлого года, на дорогах его можно встретить не так часто. Конечно, обладатели европейских или японских иномарок в большинстве с…
Дом и семьяКак лечить «манку» у рыб: фурацилином, солью, «Антипаром»?
Появление белых точек на теле вашей любимой рыбки вызывает настоящую панику. Ихтиофтироз и как лечить «манку» у рыб — тема нашей статьи. Мы поможем новичкам справиться с проблемой. Любители и те, кто серьезно занимает…
Дом и семьяЗачем нужна соль для посудомоечной машины Finish?
Современная бытовая техника призвана облегчать быт потребителя. С такими помощниками можно экономить кучу времени и сил. Но и ухода требует она должного. При использовании бытовых приборов и техники необходимо использ…
monateka.com

