Уточните контекст, иначе ваш пошлют в Яндекс, и я буду первый |
яндекс и иже с ним, дают всякие сцылки на аптеки, лекарства и тд. а значения я штото не нашол. |
на первый взгляд — кусок названия комплексного соединения, в состав которого кроме центрального атома входят вода и хлорид-ион |
10/08/2006 16:31 ну положим, того же самого » кокаина гидрохлорид», чем отличается от обычного кокса? |
а можно таки контекст? |
блин, или я туплю или одно из двух ))))), что происходит с веществом, после чего ему добавляют название Гидрохлорид?? |
значит, что в его состав входят вода и хлорид — ион. Как меняются
свойства? У каждого вещества это индивидуально. |
Upd. Нет воды. Таки HCl |
Хлорид натрия, а не гидрохлорид натрия. «почувствуйте разницу» |
10/08/2006 16:34 Водорастворимостью |
ои батенька, да вам с такими вопросами в сообщестро ru_drugs… тамошние товарищи точно чемнибудь помогут… |
|
Если насчет органики, то я согласна. Просто автор вопроса не указал, к
какому соединению это все относится. |
|
примерно понял. ( хотя ничего не понял :)) ) |
Гидрохлорид — гидроксиламин солянистокислый NH 2 OH • HCl бесцветные гидроскопические кристаллы. |
если с ним получаются более сложные, тогда он |
Это соединение металл+водород+хлор. |
Пример такого соединения приведите, пожалуйста. Очень любопытно посмотреть на металл+водород+хлор. |
Не, не приведу. |
Угу. Так я и думала. Результат реакции металла с соляной кислотой называется хлоридом. |
Ну лоханулась. Бывает. |
если речь про лекарства, к примеру Гидрохлоридом чего-то чаще всего называют соединение основного органического вещества с хлороводородом (соляной кислотой) HCl. Чаще всего в стурктуре того самого органического вещества присутствует
азот (N) в какой-либо форме (полностью связанный с атомами углерода в
гетероциклах, к примеру, или в виде амино-группы Nh3). При проведении
реакции водород (Н) из хлороводорода «присоединяется» к азоту с
образованием положительно заряженной NH+ (в случае гетероцикла) или
Nh4+ (в случае аминогруппы). А Cl «остается» в виде Cl-. |
Огр спсб. Куда намного лучше, то что надо!! |
Кислая соль. Кислотный остаток HCL. |
Как Вы себе представляете кислую соль одноосновной кислоты, вот мне интересно. |
Хм… Ну если честно плохо) Так что видимо я не прав. Хотя исходя чисто из названия вроде логичный ответ:) |
Совершенно нет 🙂 Уж Вы поверьте химику :)))))))))) |
Да я-то вам поверю 🙂 Просто интересно, если бы вопрос стоял про, скажем, гидрокарбонат или гидросульфат какой-нибудь, разве это не кислая соль?) |
Причем здесь «если бы вопрос стоял»?! Вопрос стоял конкретно про гидрохлорид. |
|
Ответ был бы логичным и (частично) правильным, если бы речь шла про многоосновные кислоты. НЕ БЫВАЕТ кислых солей одноосновных кислот. Исходя из названия и не задумываясь о структуре молекулы в химии судить нельзя ни о чем. |
Ну вот, понятно, спасибо) |
Да, я зануда, зануда :)))) |
🙂 Да ладно вам:) |
www.ljpoisk.ru
гидрохлорид п-гуанидиносалицилата натрия — патент РФ 2237658
Изобретение относится к области медицины и ветеринарии и касается нового соединения, обладающего противотуберкулезной активностью и представляющего собой п-гуанидиносалицилат натрия формулы 1. Соединение обладает повышенной эффективностью действия и сниженной токсичностью при лечении туберкулеза. 1 табл.
Изобретение относится к медицине, а именно к лекарственным препаратам для лечения туберкулеза, а также ветеринарии.
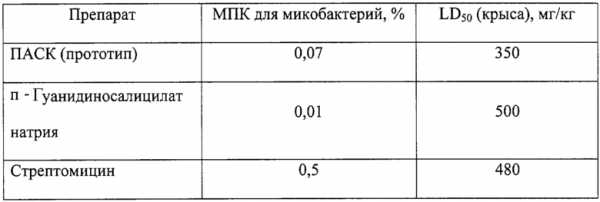
Известен противотуберкулезный препарат п-аминосалициловая кислота (ПАСК) и ее натриевая соль (Энциклопедия лекарств. — 8-е изд. под ред. Ю.Ф.Крылова. — М.: “РЛС”, 2001, стр. 76).
Недостатками этого препарата являются достаточно высокая токсичность и сравнительно быстрое привыкание к нему микобактерий туберкулеза.
Известен также противотуберкулезный препарат стрептомицин — производное основания гуанидина (Энциклопедия лекарств. — 8-е изд. под ред. Ю.Ф.Крылова. — М.: “РЛС”, 2001, стр. 813).
Его недостатками являются сравнительно низкая активность (10-кратные дозы по сравнению с ПАСК), а также вредное воздействие на организм (повреждение слухового нерва).
Технической задачей изобретения является снижение токсичности и повышение эффективности действия препарата в борьбе с туберкулезной инфекцией.
Для решения технической задачи синтезирован новый противотуберкулезный препарат, представляющий собой гидрохлорид п-гуанидиносалицилата натрия, имеющий следующую структурную формулу:
Сущность изобретения поясняется следующим образом.
В новом соединении сохранена физиологически активная структура п-замещенной салициловой кислоты и, кроме того, присутствует гуанидиновая группировка в более стабильной и в менее опасной гидрохлоридной форме, также эффективная против микобактерий туберкулеза. Отсутствие аминогруппы анилинового типа в молекуле гуанидиносалицилата повышает его устойчивость к окислению воздухом и снижает токсичность. В результате новый препарат представляет собой стабильное кристаллическое вещество белого цвета, которое легко очищается перекристаллизацией из спирта и промыванием ацетоном.
Молекулярный вес препарата почти вдвое превышает молекулярный вес исходной ПАСК.
Очищенный таким образом гидрохлорид п-гуанидиносалицилата натрия представляет собой белый кристаллический порошок с температурой плавления 130С.
Солеобразная форма обеспечивает дополнительное снижение токсичности и повышение стабильности препарата.
Синтез гидрохлорида п-гуанидиносалицилата натрия осуществляют следующим способом.
Порцию ПАСК растворяют в эквимольном количестве крепкого раствора едкого натра. К полученному раствору добавляют эквимольное количество хлористого аммония, и полученный раствор обезвоживают досуха. При этом одновременно происходит удаление газообразного аммиака
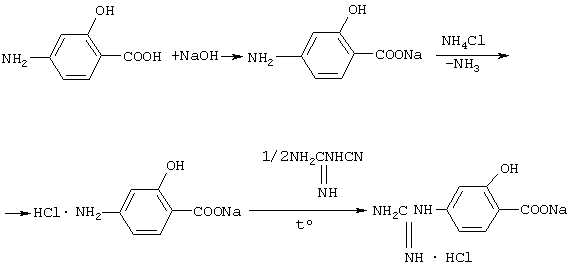
Полученную гидрохлоридную соль п-аминосалицилата натрия измельчают и смешивают с полумольным количеством дициандиамида. Смесь нагревают до температуры 150С на масляной бане до полного расплавления и получают гидрохлорид п-гуанидиносалицилата натрия. Темно окрашенный продукт реакции охлаждают и растворяют в небольшом количестве спирта при нагревании (50-60С).
Раствор фильтруют и охлаждают. При этом из раствора кристаллизуется осадок гидрохлорида 4-гуанидиносалицилата натрия. Кристаллический осадок отфильтровывают и промывают несколько раз ацетоном, в котором он нерастворим, до полного удаления окрашенной примеси ПАСК с продуктами ее окисления, высушивают и анализируют. При необходимости процесс перекристаллизации может быть повторен. Определяют минимальную задерживающую концентрацию препарата для микобактерий туберкулеза и пероральную токсичность для крыс. Полученные данные приведены в таблице.
Пример конкретного выполнения
Порцию 13,9 г (0,1 моля) п-аминосалициловой кислоты растворяют в 10 мл воды вместе с 4 г едкого натра, затем в полученный раствор добавляют 5,5 г хлористого аммония, и полученная реакционная смесь высушивается, измельчается в порошок и смешивается с 4,2 г (0,05 моля) дициандиамида. Полученная смесь нагревается в стаканчике на масляной бане при температуре 120С. При этом происходит расплавление смеси и ее окрашивание в темно-красный цвет.
После охлаждения расплава реакционной смеси ее измельчают и растворяют при нагревании до температуры 50С в 100 мл спирта. Профильтрованный спиртовой раствор реакционной смеси охлаждают до комнатной температуры. При этом наблюдалось образование темноокрашенного осадка. Осадок отфильтровывают и промывают 4 раза порциями ацетона по 20 мл. В результате получено 18 г светло-розового гидрохлорида п-гуанидиносалицилата натрия с температурой плавления 130С и элементным анализом C8H9N3O3ClNa.
Вычислено, %: С 38,0; N 16,6; Cl 14,0.
Найдено, %: С 37,7; N 15,9; Cl 14,1.
Получен гидрохлорид п-гуанидиносалицилата натрия, имеющий следующую структурную формулу:
ФОРМУЛА ИЗОБРЕТЕНИЯ
Гидрохлорид п-гуанидиносалицилата натрия, имеющий следующую структурную формулу:
www.freepatent.ru
Формула Гипохлорита натрия структурная химическая
Структурная формула
Истинная, эмпирическая, или брутто-формула: ClNaO
Химический состав Гипохлорита натрия
| Символ | Элемент | Атомный вес | Число атомов | Процент массы |
|---|---|---|---|---|
| Cl | Хлор | 35.453 | 1 | 47,6% |
| Na | Натрий | 22.99 | 1 | 30,9% |
| O | Кислород | 15.999 | 1 | 21,5% |
Молекулярная масса: 74.442
Гипохлори́т на́трия (натрий хлорноватистокислый) — NaOCl, неорганическое соединение, натриевая соль хлорноватистой кислоты. Тривиальное (историческое) название водного раствора соли — «лабарракова вода» или «жавелевая вода». Соединение в свободном состоянии очень неустойчиво, обычно используется в виде относительно стабильного пентагидрата NaOCl · 5h3O или водного раствора, имеющего характерный резкий запах хлора и обладающего высокими коррозионными свойствами. Соединение — сильный окислитель, содержит 95,2 % активного хлора. Обладает антисептическим и дезинфицирующим действием. Используется в качестве бытового и промышленного отбеливателя и дезинфектанта, средства очистки и обеззараживания воды, окислителя для некоторых процессов промышленного химического производства. Как бактерицидное и стерилизующее средство применяется в медицине, пищевой промышленности и сельском хозяйстве. По мнению издания The 100 Most Important Chemical Compounds (Greenwood Press, 2007), гипохлорит натрия входит в сотню самых важных химических соединений.
История открытия
В 1774 году шведским химиком Карлом Вильгельмом Шееле был открыт хлор. Спустя 11 лет в 1785 году (по другим данным — в 1787 году), другой химик, француз Клод Луи Бертолле, обнаружил, что водный раствор этого газа (см. уравнение (1)) обладает отбеливающими свойствами:
Cl+H2O=HCl+HOCl
Небольшое Парижское предприятие Societé Javel, открытое в 1778 году на берегах Сены и возглавляемое Леонардом Альбаном (англ. Leonard Alban), адаптировало открытие Бертолле к промышленным условиям и начало выпуск белильной жидкости, растворяя газообразный хлор в воде. Однако получаемый продукт был очень нестабильным, поэтому в 1787 году процесс был модифицирован. Хлор стали пропускать через водный раствор поташа (карбоната калия), в результате чего образовывался стабильный продукт, обладающий высокими отбеливающими свойствами. Альбан назвал его «Eau de Javel» («жавелевая вода»). Новый продукт стал моментально популярен во Франции и Англии из-за лёгкости его перевозки и хранения.
В 1820 году французский аптекарь Антуан Лабаррак (фр. Antoine Germain Labarraque) заменил поташ на более дешёвую каустическую соду (гидроксид натрия). Получившийся раствор гипохлорита натрия получил название «Eau de Labarraque» («лабарракова вода»). Он стал широко использоваться для отбеливания и дезинфекции.
Несмотря на то, что дезинфицирующие свойства гипохлорита были обнаружены в первой половине XIX века, использование его для обеззараживания питьевой воды и очистки сточных вод началось только в конце века. Первые системы водоочистки были открыты в 1893 году в Гамбурге; в США первый завод по производству очищенной питьевой воды появился в 1908 году в Джерси-Сити.
Физические свойства
Безводный гипохлорит натрия представляет собой неустойчивое бесцветное кристаллическое вещество.
Элементный состав: Na (30,9 %), Cl (47,6 %), O (21,5 %).
Хорошо растворим в воде: 53,4 г в 100 граммах воды (130 г на 100 г воды при 50 °C).
У соединения известно три кристаллогидрата:
- моногидрат NaOCl · H2O — крайне неустойчив, разлагается выше 60 °C, при более высоких температурах — со взрывом
- NaOCl · 2,5H2O — более устойчив, плавится при 57,5 °C.
пентагидрат NaOCl · 5H2O — наиболее устойчивая форма, представляет собой бледно-зеленовато-жёлтые (технического качества — белые) ромбические кристаллы (a = 0,808 нм, b = 1,606 нм, c = 0,533 нм, Z = 4). Не гигроскопичен, хорошо растворим в воде (в г/100 граммов воды, в пересчёте на безводную соль): 26 (−10 °C), 29,5 (0 °C), 38 (10 °C), 82 (25 °C), 100 (30 °C). В воздухе расплывается, переходя в жидкое состояние, из-за быстрого разложения. Температура плавления: 24,4 °C (по другим данным: 18 °C), при нагревании (30—50 °C) разлагается.
Плотность водного раствора гипохлорита натрия при 18 °C:
| 1% | 2% | 4% | 6% | 8% | 10% | 14% | |
|---|---|---|---|---|---|---|---|
| Плотность, г/л | 1005,3 | 1012,1 | 1025,8 | 1039,7 | 1053,8 | 1068,1 | 1097,7 |
| 18 % | 22 % | 26 % | 30 % | 34 % | 38 % | 40 % | |
| 1128,8 | 1161,4 | 1195,3 | 1230,7 | 1268,0 | 1308,5 | 1328,5 |
Температура замерзания водных растворов гипохлорита натрия различных концентраций:
| 0,8 % | 2 % | 4 % | 6 % | 8 % | 10 % | 12 % | 15,6 % | |
|---|---|---|---|---|---|---|---|---|
| Температура замерзания, С | −1,0 | −2,2 | −4,4 | −7,5 | −10,0 | −13,9 | −19,4 | −29,7 |
Термодинамические характеристики гипохлорита натрия в бесконечно разбавленном водном растворе:
- стандартная энтальпия образования, ΔHo298: −350,4 кДж/моль;
- стандартная энергия Гиббса, ΔGo298: −298,7 кДж/моль.
Химические свойства
Разложение и диспропорционирование Гипохлорит натрия — неустойчивое соединение, легко разлагающееся с выделением кислорода.Самопроизвольное разложение медленно происходит даже при комнатной температуре: за 40 суток пентагидрат (NaOCl · 5H2O) теряет 30 % активного хлора. При температуре 70 °C разложение безводного гипохлорита протекает со взрывом. При нагревании параллельно происходит реакция диспропорционирования.
Гидролиз и разложение в водных растворах
Растворяясь в воде, гипохлорит натрия диссоциирует на ионы. Так как хлорноватистая кислота (HOCl) очень слабая (pKa = 7,537), гипохлорит-ион в водной среде подвергается гидролизу.
Именно наличие хлорноватистой кислоты в водных растворах гипохлорита натрия объясняет его сильные дезинфицирующие и отбеливающие свойства. Водные растворы гипохлорита натрия неустойчивы и со временем разлагаются даже при обычной температуре (0,085 % в сутки). Распад ускоряет освещение, ионы тяжёлых металлов и хлориды щелочных металлов; напротив, сульфат магния, ортоборная кислота, силикат и гидроксид натрия замедляют процесс; при этом наиболее устойчивы растворы с сильнощелочной средой (pH > 11).
Окислительные свойства
Водный раствор гипохлорита натрия — сильный окислитель, вступающий в многочисленные реакции с разнообразными восстановителями, независимо от кислотно-щелочного характера среды.
Идентификация
Среди качественных аналитических реакций на гипохлорит-ион можно отметить выпадение коричневого осадка метагидроксида при добавлении при комнатной температуре испытуемого образца к щелочному раствору соли одновалентного таллия (предел обнаружения 0,5 мкг гипохлорита).
Другой вариант — иодкрахмальная реакция в сильнокислой среде и цветная реакция с 4,4’-тетраметилдиаминодифенилметаном или n, n’-диокситрифенилметаном в присутствии бромата калия. Распространённым методом количественного анализа гипохлорита натрия в растворе является потенциометрический анализ методом добавок анализируемого раствора к стандартному раствору (МДА) или метод уменьшения концентрации анализируемого раствора при его добавлении к стандартному раствору (МУА) с использованием бром-ионоселективного электрода (Br-ИСЭ). Также используется титриметрический метод с использованием иодида калия (косвенная иодометрия).
Коррозионное воздействие
Гипохлорит натрия оказывает довольно сильное коррозионное воздействие на различные материалы, о чём свидетельствуют приведённые ниже данные:
| Материал | Концентрация NaOCl, масс. % | Форма воздействия | Температура, °C | Скорость и характер коррозии |
|---|---|---|---|---|
| Алюминий | 10; pH>7 | водный раствор | 25 | > 10 мм/год |
| Медь | 20 | водный раствор | 25 | > 10 мм/год |
| Медные сплавы | 10 | водный раствор | 25 | > 10 мм/год |
| Никель | 34 | водный раствор | 25 | 0,1—3,0 мм/год |
Физиологическое действие и воздействие на окружающую среду
NaOCl одно из лучших известных средств, проявляющих благодаря гипохлорит-иону сильную антибактериальную активность. Он убивает микроорганизмы очень быстро и уже в очень низких концентрациях. Наивысшая бактерицидная способность гипохлорита проявляется в нейтральной среде, когда концентрации HClO и гипохлорит-анионов ClO− приблизительно равны (см. подраздел «Гидролиз и разложение в водных растворах»). Разложение гипохлорита сопровождается образованием ряда активных частиц и, в частности, синглетного кислорода, обладающего высоким биоцидным действием. Образующиеся частицы принимают участие в уничтожении микроорганизмов, взаимодействуя с биополимерами в их структуре, способными к окислению. Исследованиями установлено, этот процесс аналогичен, тому что происходит естественным образом во всех высших организмах. Некоторые клетки человека (нейтрофилы, гепатоциты и др.) синтезируют хлорноватистую кислоту и сопутствующие высокоактивные радикалы для борьбы с микроорганизмами и чужеродными субстанциями. Дрожжеподобные грибы, вызывающие кандидоз, Candida albicans, погибают in vitro в течение 30 секунд при действии 5,0—0,5%-го раствора NaOCl; при концентрации действующего вещества ниже 0,05 % они проявляют устойчивость спустя 24 часа после воздействия. Более резистентны к действию гипохлорита натрия энтерококки. Так, например, патогенный Enterococcus faecalis погибает через 30 секунд после обработки 5,25%-м раствором и через 30 минут после обработки 0,5%-м раствором. Грамотрицательные анаэробные бактерии, такие как Porphyromonas gingivalis, Porphyromonas endodontalis и Prevotella intermedia, погибают в течение 15 секунд после обработки 5,0—0,5%-м раствором NaOCl. Несмотря на высокую биоцидную активность гипохлорита натрия, следует иметь в виду, что некоторые потенциально опасные простейшие организмы, например, возбудители лямблиоза или криптоспоридиоза, устойчивы к его действию. Высокие окислительные свойства гипохлорита натрия позволяют его успешно использовать для обезвреживания различных токсинов. В приведённой ниже таблице представлены результаты инактивации токсинов при 30-минутной экспозиции различных концентраций NaOCl («+» — токсин инактивирован; «−» — токсин остался активен). На организм человека гипохлорит натрия может оказывать вредное воздействие. Растворы NaOCl могут быть опасны при ингаляционном воздействии из-за возможности выделения токсичного хлора (раздражающий и удушающий эффект). Прямое попадание гипохлорита в глаза, особенно при высоких концентрациях, может вызвать химический ожог и даже привести к частичной или полной потере зрения. Бытовые отбеливатели на основе NaOCl могут вызвать раздражение кожи, а промышленные привести к серьёзным язвам и отмиранию ткани. Приём внутрь разбавленных растворов (3—6 %) гипохлорита натрия приводит обычно только к раздражению пищевода и иногда ацидозу, в то время как концентрированные растворы способны вызвать довольно серьёзные повреждения, вплоть до перфорации желудочно-кишечного тракта. Несмотря на свою высокую химическую активность, безопасность гипохлорита натрия для человека документально подтверждена исследованиями токсикологических центров Северной Америки и Европы, которые показывают, что вещество в рабочих концентрациях не несёт каких-либо серьёзных последствий для здоровья после непреднамеренного проглатывания или попадания на кожу. Также подтверждено, что гипохлорит натрия не является мутагенным, канцерогенным и тератогенным соединением, а также кожным аллергеном. Международное агентство по изучению рака пришло к выводу, что питьевая вода, прошедшая обработку NaOCl, не содержит человеческих канцерогенов.
Пероральная токсичность соединения:
- Мыши: ЛД50 (англ. LD50) = 5800 мг/кг;
- Человек (женщины): минимально известная токсическая доза англ. (англ. TDLo) = 1000 мг/кг.
Внутривенная токсичность соединения:
- Человек: минимально известная токсическая доза (англ. TDLo) = 45 мг/кг.
При обычном бытовом использовании гипохлорит натрия распадается в окружающей среде на поваренную соль, воду и кислород. Другие вещества могут образоваться в незначительном количестве. По заключению Шведского института экологических исследований, гипохлорит натрия, скорее всего, не создаёт экологических проблем при его использовании в рекомендованном порядке и количествах. Гипохлорит натрия не представляет угрозы с точки зрения пожароопасности.
Промышленное производство
Мировое производство
Оценка мирового объёма производства гипохлорита натрия представляет определённую трудность в связи с тем, что значительная его часть производится электрохимическим способом по принципу «in situ», то есть на месте его непосредственного потребления (речь идёт об использовании соединения для дезинфекции и подготовки воды). По данным на 2005 год, приблизительный глобальный объём производства NaOCl составил около 1 млн тонн, при этом почти половина этого объёма была использована для бытовых, а другая половина — для промышленных нужд.
Обзор промышленных способов получения
Выдающиеся отбеливающие и дезинфекционные свойства гипохлорита натрия привели к интенсивному росту его потребления, что в свою очередь дало стимул для создания крупномасштабных промышленных производств.
В современной промышленности существует два основных метода производства гипохлорита натрия:
- химический метод — хлорирование водных растворов гидроксида натрия;
- электрохимический метод — электролиз водного раствора хлорида натрия.
Применение
Обзор направлений использования
Гипохлорит натрия является безусловным лидером среди гипохлоритов других металлов, имеющих промышленную значимость, занимая 91 % мирового рынка. Почти 9 % остаётся за гипохлоритом кальция, гипохлориты калия и лития имеют незначительные объёмы использования.
Весь широкий спектр использования гипохлорита натрия можно разбить на три условные группы:
- использование для бытовых целей;
- использование для промышленных целей;
- использование в медицине.
Бытовое использование включает в себя:
- использование в качестве средства для дезинфекции и антибактериальной обработки;
- использование для отбеливания тканей;
- химическое растворение санитарно-технических отложений.
Промышленное использование включает в себя:
- промышленное отбеливание ткани, древесной массы и некоторых других продуктов;
- промышленная дезинфекция и санитарно-гигиеническая обработка;
- очистка и дезинфекция питьевой воды для систем коммунального водоснабжения;
- очистка и обеззараживание промышленных стоков;
- химическое производство.
По оценке экспертов IHS, около 67 % всего гипохлорита натрия используется в качестве отбеливателя и 33 % для нужд дезинфекции и очистки, причём последнее направление имеет тенденцию к росту. Наиболее распространённое направление промышленного использования гипохлорита (60 %) — дезинфекция промышленных и бытовых сточных вод. Общий глобальный рост объёмов промышленного потребления NaOCl в 2012—2017 гг оценивается в 2,5 % ежегодно. Рост мирового спроса на гипохлорит натрия для бытового использования в 2012—2017 гг оценивается примерно в 2 % ежегодно.
Применение в бытовой химии
Гипохлорит натрия находит широкое применение в бытовой химии и входит в качестве активного ингредиента многочисленных средств, предназначенных для отбеливания, очистки и дезинфекции различных поверхностей и материалов. В США примерно 80 % всего гипохлорита, используемого домохозяйствами, приходится на бытовое отбеливание. Обычно, в быту применяются растворы с концентрацией в диапазоне от 3 до 6 % гипохлорита. Коммерческая доступность и высокая эффективность действующего вещества определяет его широкое использование различными производственными компаниями, где гипохлорит натрия или средства на его основе выпускаются под различными торговыми марками.
Применение в медицине
Использование гипохлорита натрия для дезинфекции ран впервые было предложено не позднее 1915 года. В современной медицинской практике антисептические растворы гипохлорита натрия используются, в основном, для наружного и местного применения в качестве противовирусного, противогрибкового и бактерицидного средства при обработке кожи, слизистых оболочек и ран. Гипохлорит активен в отношении многих грамположительных и грамотрицательных бактерий, большинства патогенных грибов, вирусов и простейших, хотя его эффективность снижается в присутствии крови или её компонентов. Низкая стоимость и доступность гипохлорита натрия делает его важным компонентом для поддержания высоких гигиенических стандартов во всём мире. Это особенно ярко проявляется в развивающихся странах, где использование NaOCl стало решающим фактором для остановки холеры, дизентерии, брюшного тифа и других водных биотических заболеваний. Так, при вспышке холеры в странах Латинской Америки и Карибского бассейна в конце XX века благодаря гипохлориту натрия удалось свести к минимуму заболеваемость и смертность, что было сообщено на симпозиуме по тропическим болезням, проводимого под эгидой Института Пастера. Для медицинских целей в России гипохлорит натрия используется в качестве 0,06%-го раствора для внутриполостного и наружного применения, а также раствора для инъекций. В хирургической практике он применяется для обработки, промывания или дренирования операционных ран и интраоперационной санации плевральной полости при гнойных поражениях; в акушерстве и гинекологии — для периоперационной обработки влагалища, лечения бартолинита, кольпита, трихомониаза, хламидиоза, эндометрита, аднексита и т. п.; в оториноларингологии — для полосканий носа и горла, закапывания в слуховой проход; в дерматологии — для влажных повязок, примочек, компрессов при различных видах инфекций. В стоматологической практике гипохлорит натрия наиболее широко применяется в качестве антисептического ирригационного раствора (концентрация NaOCl 0,5—5,25 %) в эндодонтии. Популярность NaOCl определяется общедоступностью и дешевизной раствора, а также бактерицидным и противовирусным эффектом в отношении таких опасных вирусов как ВИЧ, ротавирус, вирус герпеса, вирусы гепатита A и B. Имеются данные об использовании гипохлорита натрия для лечения вирусных гепатитов: он обладает широким спектром противовирусных, детоксикационных и антиоксидантных эффектов. Растворы NaOCl можно использовать в целях стерилизации некоторых медицинских изделий, предметов ухода за больными, посуды, белья, игрушек, помещений, твёрдой мебели, сантехнического оборудования. Из-за высокой коррозионной активности, гипохлорит не применяют для металлических приборов и инструментов. Отметим также применение растворов гипохлорита натрия в ветеринарии: они используются для дезинфекции животноводческих помещений.
Промышленное применение
Применение в качестве промышленного отбеливателя
Использования гипохлорита натрия в качестве отбеливателя является одним из приоритетных направлений промышленного использования наряду с дезинфекцией и очисткой питьевой воды. Мировой рынок только в этом сегменте превышает 4 млн тонн. Обычно, для промышленных нужд в качестве отбеливателя используются водные растворы NaOCl, содержащие 10—12 % действующего вещества. Гипохлорит натрия широко используется в качестве отбеливателя и пятновыводителя в текстильном производстве и промышленных прачечных и химчистках. Он может быть безопасно использован для многих видов тканей, включая хлопок, полиэстер, нейлон, ацетат, лён, вискозу и другие. Он очень эффективен для удаления следов почвы и широкого спектра пятен в том числе, кровь, кофе, трава, горчица, красное вино и т. д. Гипохлорит натрия также используется в целлюлозно-бумажной промышленности для отбелки древесной массы. Отбелка с использованием NaOCl обычно следует за этапом хлорирования и является одной из ступеней химической переработки древесины, используемой для достижения высокой степени белизны целлюлозы. Обработку волокнистых полуфабрикатов проводят в специальных башнях гипохлоритной отбелки в щелочной среде (pH 8—9), температуре 35—40 °C, в течение 2—3 часов. В течение этого процесса происходит окисление и хлорирование лигнина, а также разрушение хромофорных групп органических молекул.
Применение в качестве промышленного дезинфицирующего средства
Широкое применение гипохлорита натрия в качестве промышленного дезинфицирующего средства связано, прежде всего, со следующими направлениями:
- дезинфекция питьевой воды перед подачей в распределительные системы городского водоснабжения;
- дезинфекция и альгицидная обработка воды плавательных бассейнов и прудов;
- обработка бытовых и промышленных сточных вод, очистка от органических и неорганических примесей;
- в пивоварении, виноделии, молочной промышленности — дезинфекция систем, трубопроводов, резервуаров;
- фунгицидная и бактерицидная обработка зерна;
- дезинфекция воды рыбохозяйственных водоёмов;
- дезинфекция технических помещений.
Гипохлорит как дезинфектант входит в состав некоторых средств для поточной автоматизированной мойки посуды и некоторых других жидких синтетических моющих средств. Промышленные дезинфицирующие и отбеливающие растворы выпускаются многими производителями под различными торговыми марками.
Использование для дезинфекции воды
Окислительная дезинфекция с помощью хлора и его производных — едва ли не самый распространённый практический метод обеззараживания воды, начало массового использование которого многими странами Западной Европы, США и Россией датируется первой четвертью XX века.
Использование гипохлорита натрия в качестве дезинфицирующего агента взамен хлора является перспективным и обладает рядом существенных преимуществ:
- реагент может быть синтезирован электрохимическим методом непосредственно на месте использования из легкодоступной поваренной соли;
- необходимые показатели качества питьевой воды и воды для гидротехнических сооружений могут быть достигнуты за счёт меньшего количества активного хлора;
- концентрация канцерогенных хлорорганических примесей в воде после обработки существенно меньше;
- замена хлора на гипохлорит натрия способствует улучшению экологической обстановки и гигиенической безопасности[79]:[стр. 36].
- гипохлорит обладает более широким спектром биоцидного действия на различные типы микроорганизмов при меньшей токсичности;
Для целей очистки бытовой воды используются разбавленные растворы гипохлорита натрия: типовая концентрация активного хлора в них составляет 0,2—2 мг/л против 1—16 мг/л для газообразного хлора[80]. Разбавление промышленных растворов до рабочей концентрации производят непосредственно на месте.
Также с технической точки зрения, принимая во внимание условие использования в РФ, эксперты отмечают:
- существенно более высокую степень безопасности технологии производства реагента;
- относительную безопасность хранения и транспортировки до места использования;
- лояльные требования к технике безопасности при работе с веществом и его растворами на объектах;
- неподведомственность технологии обеззараживания воды гипохлоритом Ростехнадзору РФ.
Использование гипохлорита натрия для дезинфекции воды в России становится все более популярным и активно внедряется в практику ведущими промышленными центрами страны. Так, в конце 2009 года, в Люберцах началось строительство завода по производству NaOCl мощностью 50 тыс. тонн/год для нужд Московского городского хозяйства. Правительством Москвы было принято решение о переводе систем обеззараживания воды московских станции водоподготовки с жидкого хлора на гипохлорит натрия (с 2012 г.). Завод по производству гипохлорита натрия будет введён в эксплуатацию в 2015 г.
Производство гидразина
Гипохлорит натрия используется в так называемом процесса Рашига (англ. Raschig Process, окисление аммиака гипохлоритом) — основном промышленном способе получения гидразина, открытого немецким химиком Фридрихом Рашигом в 1907 году. Химия процесса выглядит следующим образом: на первой стадии аммиак окисляется до хлорамина, который затем, реагирует с аммиаком, образуя собственно гидразин.
Прочие направления использования
Среди прочих направлений использования гипохлорита натрия отметим:
- в промышленном органическом синтезе или гидрометаллургическом производстве для дегазации токсичных жидких и газообразных отходов, содержащих циановодород или цианиды;
- окислитель для очистки сточных вод промышленных предприятий от примесей сероводорода, неорганических гидросульфидов, сернистых соединений, фенолов и др.;
- в электрохимических производствах в качестве травителя для германия и арсенида галлия;
- в аналитической химии как реагент для фотометрического определения бромид-иона;
- в пищевой и фармацевтической промышленности для получения пищевого модифицированного крахмала;
- в военном деле как средство для дегазации боевых отравляющих веществ, таких как иприт, льюизит, зарин и V-газы.
formula-info.ru
Гидрохлорид натрия — Химия и нефтехимия Агентство корпоративных новостей TopPRnews
Гидрохлорид натрия становится все более популярным дезинфектантом на предприятиях (станциях, сооружениях, узлах) жилищно-коммунальных и водопроводно-канализационных хозяйств России и зарубежья. Вот уже несколько лет, как все стремятся заменить устаревшие и небезопасные системы, использовавшие ранее метод хлорирования, на современные перспективные схемы и системы водоочистки и обеззараживания воды. Гидрохлорид натрия— среди «избранных».
С формулировкой «Замена системы обеззараживания питьевой и хозяйственной воды: переход с жидкого хлора на гидрохлорид натрия» за последние годы многие профильные объекты (предприятия) городских и муниципальных хозяйств, имеющие отношение к водообработке и водоподготовке, «шагнули в XXI век». Это целый ряд действительно хозяйствующих и хозяйственных организаций больших и малых городов России.
Такой переход — от хлора на гидрохлорид натрия — позволил по-настоящему улучшить качество хозяйственной и питьевой воды по многим параметрам, защитить экологию, уменьшить коррозию труб и других водопроводных магистралей. В случае применения гидрохлорида натрия для обеззараживания плавательных комплексов (бассейнов) — он значимо и напрямую в хорошую сторону влияет на настроение и здоровье пользователей.
При помощи новейших технологий, аппаратуры и оборудования, разработанных, изготавливаемых и поставляемых НПО «Эко-технология» (http://www.ecotehnologia.ru), на мембранных электролизерах можно с высокими техническими и экономическими показателями применять гидрохлорид натрия и использовать преимущества метода электролиза поваренной соли для целей обеззараживания воды.
Кроме того, гидрохлорид натрия, получаемый в процессе реакции при электролизе NaCl на мембранных электролизерах, может быть аккумулирован и сохранен для дальнейшего дополнительного (или основного) использования для других целей производства, хозяйства или даже коммерции.
Подробности см. http://www.ecotehnologia.ru
Контактная информация:
Сайт компании: http://www.ecotehnologia.ru
Адрес организации: 198096 г. Санкт-Петербург, ул. Кронштадтская 3-а, офис 2
Контактное лицо: Коровин А.
ведущий специалист
E-mail: [email protected]
Телефон: +7 812 993-10-58
Факс: +7 812 783-36-13
topprnews.ru
Хлорит натрия — это… Что такое Хлорит натрия?
Хлорит натрия — неорганическое соединение, соль щелочного металла натрия и хлористой кислоты с формулой NaClO2, бесцветные кристаллы, растворимые в воде, образует кристаллогидрат.
Получение
Физические свойства
Хлорит натрия образует бесцветные кристаллы моноклинной сингонии, пространственная группа I 2/a.
Хорошо растворяется в холодной воде с гидролизом по аниону. Разлагается в горячей воде.
Образует кристаллогидрат состава NaClO2•3H2O.
Химические свойства
- Кристаллогидрат разлагается при незначительном нагревании:
- Разлагается в горячей воде:
- Является сильным окислителем в кислой среде:
Применение
Литература
- Химическая энциклопедия / Редкол.: Зефиров Н.С. и др.. — М.: Большая Российская энциклопедия, 1998. — Т. 5. — 783 с. — ISBN 5-85270-310-9
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0
Растворимость кислот, оснований и солей в воде | |
|---|---|
{| border=»0″ cellpadding=»0″ cellspacing=»1″ |- | | | |H+ | |Li+ | |K+ | |Na+ | |NH4+ | |Ba2+ | |Ca2+ | |Mg2+ | |Sr2+ | |Al3+ | |Cr3+ | |Fe2+ | |Fe3+ | |Ni2+ | |Co2+ | |Mn2+ | |Zn2+ | |Ag+ | |Hg2+ | |Hg22+ | |Pb2+ | |Sn2+ | |Cu+ | |Cu2+ |- | OH− | | P | P | P | — | P | М | Н | М | Н | Н | Н | — | Н | Н | Н | Н | Н | — | — | Н | Н | Н | Н |- | |F− | P | Н | P | P | Р | М | Н | Н | М | Р | Н | Н | Н | Р | Р | М | Р | Р | М | М | Н | Р | Н | Р |- | |Cl− | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | Н | М | — | Н | Р |- | |Br− | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | Н | М | Р | H | Р |- | |I− | P | P | P | P | Р | Р | Р | Р | Р | Р | ? | Р | — | Р | Р | Р | Р | Н | Н | Н | Н | М | Н | — |- | |S2− | P | P | P | P | — | Р | М | Н | Р | — | — | Н | — | Н | Н | Н | Н | Н | Н | — | Н | Н | Н | Н |- | |SO32− | P | P | P | P | Р | М | М | М | Н | ? | ? | М | ? | Н | Н | Н | М | Н | Н | Н | Н | ? | Н | ? |- | |SO42− | P | P | P | P | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Н | Р | Р | Р |- | |NO3− | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | — | Р | Р |- | |NO2− | P | P | P | P | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? | ? | ? |- | |PO43− | P | Н | P | P | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | ? | Н | Н | Н | Н |- | |CO32− | М | Р | P | P | Р | Н | Н | Н | Н | — | — | Н | — | Н | Н | — | Н | Н | — | Н | — | — | ? | — |- | |CH3COO− | P | Р | P | P | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | М | Р | — | Р | Р |- | |CN− | P | Р | P | P | Р | Р | Р | Р | Р | ? | Н | Н | — | Н | Н | Н | Н | Н | Р | Н | Р | — | — | Н |- | |SiO32− | H | Н | P | P | Силикат аммония| ? | Н | Н | Н | Н | Силикат алюминия(III)|? | Силикат хрома(III)|? | Н | Силикат железа(III)|? | Силикат никеля|? | Силикат кобальта(II)|? | Н | Н | Силикат серебра(I)|? | Силикат ртути(II)|? | ? | Н | Силикат олова(II)|? | Силикат меди(I)|? | Силикат меди(II)|? |} |
dic.academic.ru
Гидрид натрия. Свойства, описание и применение.
Прежде чем разобраться в том, какими свойствами обладает гидрид натрия, необходимо узнать, что это такое, где он применяется и насколько важен. На эти вопросы ответит далеко не каждый, тем не менее, незнание такой информации совсем не говорит о бесполезности данного вещества. Так же, как и другие соединения натрия, оно активно применяется в промышленности.
Попробуем разобраться в этих вопросах и начнем, пожалуй, с определения и описания данного соединения. Итак, гидрид натрия – это сложное неорганическое вещество, имеющее формулу NaH, серовато-белый или белый гигроскопический порошок. Получают его путем взаимодействия и перемешивания в инертной жидкости газообразного водорода и металлического натрия. Применяют это вещество для карбоксидирования, алкилирования и ацилирования слабых С-Н-кислот. В результате взаимодействия данного соединения с водой получается гидроксид натрия (едкий натр, натрий гидроокись).
Итак, теперь непосредственно о свойствах гидрида натрия. Прежде всего, это нейтральность по отношению к металлам, которые в стандартных условиях подвержены коррозии. При использовании данного вещества, несмотря на всевозможные царапины, шероховатости и дефекты наружной поверхности металла, оно равномерно распределяется и защищает поверхность. Гидрид натрия удобно применять в минеральном масле либо других углеводородах в виде суспензий. Для получения данного комплекса необходимо нагревание до 100 градусов. Гидрид натрия плавится при 800 градусов Цельсия, но происходит это исключительно под давлением.
Данное вещество, так же, как и гидрид кальция, титана и циркония, благоприятно влияет на вулканизаты каучука. В них оно вводится непосредственно перед процессом вулканизации в виде дисперсий в вазелине, парафиновом или минеральном масле. Гидрид натрия по некоторым своим физическим свойствам похож на хлорид натрия, но его производство немного тяжелее и более дорогостоящее. Поэтому область применения гидрида натрия обусловлена уникальными свойствами, которыми обладает только это соединение натрия. А вот химические процессы, которые протекают при участии хлорида натрия и гидрида натрия, существенно разнятся.
Гидрид натрия активно применяют для восстановления титана. Причем именно в тех случаях, когда восстановление требуется в достаточно больших объемах, то есть речь идет о промышленных масштабах. Именно это свойство данного гидрида нашло активное применение в тяжелой промышленности и в автомобилестроении. Гидрид натрия применяют и в металлургии – в тех случаях, когда необходимо из различных соединений выделить группы редких металлов, которые другими катализаторами выделить невозможно. Он получил активное применение и в других отраслях народного хозяйства. Как видно из всех выше перечисленных фактов, гидрид натрия является достаточно важным химическим соединением, которое активно используется в промышленном производстве.
Теперь пару слов о получении гидрида натрия в промышленных масштабах. При производстве гидрида натрия небольшое количество этого соединения оставляют в резервуаре, а на его поверхность подают расплавленный натрий. Резервуар – горизонтальный реактор периодического действия – представляет собой емкость, внутри которой расположен винт с двумя лопастями. Благодаря такой конструкции обеспечивается циркуляция материала внутри реактора. Очень важно следить за подачей натрия и водорода, так как при неправильных пропорциях данный гидрид может получиться в жидкой фазе. Такое явление может иметь место и при неправильном температурном режиме (повышении температуры выше допустимого значения).
fb.ru
натрия хлорид | PPDB
Каталог пестицидов — PPDB
| sodium chloride ** common salt ** rock salt ** table salt ** На других языках |
Поведение в окружающей среде — Экотоксичность — Здоровье человека — Токсиколого-гигиеническая характеристика
Описание: Неорганическая соль для использования как полный гербицид, дефолиант и dessicant
Год официальной регистрации: —
Выпуск пестицидов на рынок (директива 91/414/ЕЭС), статус:
| Статус | Исключено из Приложения 1 |
| Досье докладчика / содокладчика | — |
| Дата включения истекает | Истекла |
Разрешен к применению (V) или известен (#) в следующих Европейских странах:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Основные сведения:
| Тип пестицида | Гербицид |
| Группа по химическому строению | Неорганические соединения |
| Характер действия | Невыборочный, phytotoxic |
| Регистрационный номер CAS | 7647-14-5 |
| Шифр КФ (Код Фермента) | 231-598-3 |
| Шифр Международного совместного аналитического совета по пестицидам (CIPAC) | 8291 |
| Химический код Агентства по охране окружающей среды США (US EPA) | 013905 |
| Химическая формула | NaCl |
| SMILES | [Na+].[Cl-] |
| Международный химический идентификатор (InChI) | InChI=1/ClH.Na/h2H;/q;+1/p-1 |
| Структурная формула | |
| Молекулярная масса (г/моль) | 58.44 |
| Название по ИЮПАК | sodium chloride |
| Название по CAS | sodium chloride |
| Другая информация | — |
| Устойчивость к гербициду по HRAC | Не известно |
| Устойчивость к инсектициду по IRAC | Не определяется |
| Устойчивость к фунгициду по FRAC | Не определяется |
| Физическое состояние | Белые кристаллы |
Выпуск:
| Показатель | Значение | |||
| Производители пестицида | ||||
| Коммерческие названия препаратов, содержащих д.в. | — | |||
| С этим веществом связаны: | — | |||
| Оценка риска от пестицида для местной экологии (Англия) | No Великобритания approval for use | |||
| Препаративная форма и особенности применения | — | |||
| Растворимость в воде при 20oC (мг/л) | 357000 | P4 | Высокий | |
| Растворимость в органических растворителях при 20oC (мг/л) | — | — | — | |
| Температура плавления (oC) | 900 | AC4 | — | |
| Температура кипения (oC) | — | — | — | |
| Температура разложения (oC) | — | — | — | |
| Температура вспышки (oC) | — | — | — | |
| Коэффициент распределения в системе октанол/вода при pH 7, 20oC | P: | 3.47 X 10-01 | Рассчитывается | — |
| Log P: | -0.46 | V3 | Низкий | |
| Удельная плотность (г/мл) / Удельный вес | 2.17 | P4 | — | |
| Константа диссоциации (pKa) при 25oC | — | — | — | |
| Примечание: | ||||
| Давление паров при 25oC (МПа) | 1.00 X 10-10 | P4 | Не летуч | |
| Константа закона Генри при 25oC (Па*м3/моль) | 2.53 X 1003 | V3 | Летучий | |
| Константа закона Генри при 20oC (безразмерная) | 6.72 X 10-21 | Рассчитывается | Не летуч | |
| Период распада в почве (дни) | ДТ50 (типичный) | — | — | — |
| ДТ50 (лабораторный при 20oC): | — | — | — | |
| ДТ50 (полевой): | — | — | — | |
| ДТ90 (лабораторный при 20oC): | — | — | — | |
| ДТ90 (полевой): | — | — | — | |
| Примечание: | — | |||
| Водный фотолиз ДТ50 (дни) при pH 7 | Значение: | — | — | — |
| Примечание: | — | |||
| Водный гидролиз ДТ50 (дни) при 20oC и pH 7 | Значение: | — | — | — |
| Примечание: | — | |||
| Водное осаждение ДТ50 (дни) | — | — | — | |
| Только водная фаза ДТ50 (дни) | — | — | — | |
| Индекс потенциального вымывания GUS | — | — | — | |
| Индекс роста концентрации в грунтовых водах SCI (мкг/л) при дозе внесения 1 кг/га (л/га) | Значение: | — | — | — |
| Примечание: | — | |||
| Potential for particle bound transport index | — | — | — | |
| Koc — коэффициент распределения органического углерода (мл/г) | — | — | — | |
| pH устойчивость: | ||||
| Примечание: | ||||
| Изотерма адсорбции Фрейндлиха | Kf: | — | — | — |
| 1/n: | — | — | ||
| Примечание: | — | |||
| Максимальное УФ-поглощение (л/(моль*см)) | — | — | — | |
| Коэффициент биоконцентрации | BCF: | — | — | — |
| CT50 (дни): | — | — | ||
| Потенциал биоаккумуляции | — | Рассчитывается | Низкий | |
| Млекопитающие — Острая оральная ЛД50 (мг/кг) | > 3000 | P4 Крыса | Низкий | |
| Млекопитающие — Короткопериодный пищевой NOEL | (мг/кг): | — | — | — |
| (ppm пищи): | — | — | ||
| Птицы — Острая ЛД50 (мг/кг) | 3000 | P2 Домовый воробей | Низкий | |
| Птицы — Острая токсичность (СК50 / ЛД50) | — | — | — | |
| Рыбы — Острая 96 часовая СК50 (мг/л) | 6094 | F4 Радужная форель | Низкий | |
| Рыбы — Хроническая 21 дневная NOEC (мг/л) | — | — | — | |
| Водные беспозвоночные — Острая 48 часовая ЭК50 (мг/л) | 3310 | F4 Дафния магна (Дафния большая, Блоха водяная большая) | Низкий | |
| Водные беспозвоночные — Хроническая 21 дневная NOEC (мг/л) | — | — | — | |
| Водные ракообразные — Острая 96 часовая СК50 (мг/л) | — | — | — | |
| Донные микроорганизмы — Острая 96 часовая СК50 (мг/л) | — | — | — | |
| Донные микроорганизмы — Хроническая 28 дневная NOEC, static, Вода (мг/л) | — | — | — | |
| Донные микроорганизмы — Хроническая 28 дневная NOEC, Осадочная порода (мг/кг) | — | — | — | |
| Водные растения — Острая 7 дневная ЭК50, биомасса (мг/л) | 3950 | F2 Ряска малая, 7 день | Низкий | |
| Водоросли — Острая 72 часовая ЭК50, рост (мг/л) | — | — | — | |
| Водоросли — Хроническая 96 часовая NOEC, рост (мг/л) | — | — | — | |
| Пчелы — Острая 48 часовая ЛД50 (мкг/особь) | — | — | — | |
| Почвенные черви — Острая 14-дневная СК50 (мг/кг) | 2500 | P2 Дождевой червь | Низкий | |
| Почвенные черви — Хроническая 14-дневная максимально недействующая концентрация вещества, размножение (мг/кг) | — | — | — | |
| Другие почвенные макро-организмы, например Ногохвостки | LR50 / EC50 / NOEC / Действие (%) | — | — | — |
| Другие Членистоногие (1) | LR50 (г/га): | — | — | — |
| Действие (%): | — | — | — | |
| Другие Членистоногие (2) | LR50 (г/га): | — | — | — |
| Действие (%): | — | — | — | |
| Почвенные микроорганизмы | — | — | — | |
| Имеющиеся данные по мезомиру (мезокосму) | NOEAEC мг/л: | — | — | — |
| NOEAEC мг/л: | — | — | — | |
Основные показатели:
| Млекопитающие — Острая оральная ЛД50 (мг/кг) | > 3000 | P4 Крыса | Низкий | |
| Млекопитающие — Кожная ЛД50 (мг/кг массы тела) | > 10000 | R3 Кролик | — | |
| Млекопитающие — Ингаляционная СК50 (мг/л) | — | — | — | |
| ДСД — допустимая суточная доза (мг/кг массы тела в день) | — | — | — | |
| ARfD — среднесуточная норма потребления (мг/кг массы тела в день) | — | — | — | |
| AOEL — допустимый уровень системного воздействия на оператора | — | — | — | |
| Поглощение кожей (%) | — | — | — | |
| Директива по Опасным Веществам 76/464/ЕС | — | — | — | |
| Виды ограничений | — | — | — | |
| по категории | Общие: | — | ||
| Профессиональные: | — | |||
| Примеры Европейских МДУ (мг/кг) | Значение: | — | ||
| Примечание: | ||||
| ПДК в питьевой воде (мкг/л) | — | — | — | |
Токсиколого-гигиеническая характеристика:
V : Да, известно что вызывает
X : Нет, известно что не вызывает
? : Возможно, точно не определено
— : Нет данных
Законодательство:
| Основное | [Hygroscopic] | ||||||
| Классификация рисков Европейской Комиссии | — | ||||||
| Классификация безопасности Европейской Комиссии | — | ||||||
| Классификация ВОЗ | NL | — | Не описан | ||||
| Классификация Агентства по охране окружающей среды США (US EPA) | — | — | — | ||||
| UN Номер | — | ||||||
| Упаковка и утилизация | — | ||||||
| Английский | sodium chloride |
| Французский | chlorure de sodium |
| Немецкий | Natriumchlorid |
| Датский | natriumklorid |
| Итальянский | cloruro di sodio |
| Испанский | cloruro de sodio |
| Греческий | — |
| Словенский | natrijev klorid |
| Польский | chlorek sodu |
| Шведский | — |
| Венгерский | — |
| Голландский | — |
Последнее обновление сайта: Friday 18 February 2011
rupest.ru
